招标进行时,这些功课你都做了吗
核心提示:在药品招标中,不同品种的身份也决定了产品的分组和加分,下面具体了解一下各类身份是如何界定的。
在药品招标中,不同品种的身份也决定了产品的分组和加分,下面具体了解一下各类身份是如何界定的。
1、一类新药:未在国内外上市销售的药品。(以下6点为一类新药的研发途径和方式)
1.1通过合成或者半合成的方法制得的原料药及其制剂(如江苏豪森的吗啉硝唑、恒瑞、中国医学科学院、贝达的埃克题尼、先声药业的艾拉莫德等)
1.2天然物质中提取或者通过发酵提取的新的有效单体及其制剂;(这类制剂基本都需要做皮试)
1.3用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;(尤其是有同分异构体的药物)
1.4由已上市销售的多组份药物制备为较少组份的药物;(属于传说类的一类新药,国内近10年没有以此为理由申报的)
1.5新的复方制剂;(是现阶段比较多的一类新药,像哌拉西林钠他唑巴坦钠等,即A+B=AB,但是所有的临床、药理、毒理都需要重新做,成本较高,中国主要的一类药专利是1.5类)
1.6已在国内上市销售的制剂增加国内外均未批准的新适应症。
二类新药:改变给药途径且尚未在国内外上市销售的制剂。
二类新药也存在一定的问题,前前药监局郑的罪名之一就是因为滥发二类新药药证。但是二类新药的研发难度从某种角度说比一类新药还难,给药途径基本跳不出七种,一类新药研发成本巨大,所以有能力承担研发的都是医药巨头,给药方式已经早就做过优化,申报的就是最优的给药方式,再改的话也没有多大意义。
三类新药:已在国外上市销售但尚未在国内上市销售的药品。
4类:改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
2、首仿(在我国,以化药为例,可能属于3.1类新药范畴,也可能为6类范畴,取决于原研药品是否已在中国上市。 )
(1)“首仿”概念源于美国首仿药的概念,《药品价格竞争和专利期恢复法》规定,在“专利无效或者批准正在申请的药物不会侵犯专利”的情况下,第一个仿制申请者将拥有180天的市场专卖权。注意:在美国首仿药定义范畴为仿制药;
(2)2005年“首仿”在中国被提出 ,在2006年国家发改委发布的《药品定价办法》一文中,首次官方提出,2009年开始药品招标方案中出现“首仿” 《辽宁省2009年度医疗机构药品集中采购实施方案》中,"标准首仿药品:指首家仿照专利技术生产的药品,以国家食品药品监督管理局批准文号批准时间,结合质量标准起草证明为依据,其化学名必须与原研制药品完全一致,适应症与原研药品一致"。
《2009江苏省药品集中采购方案》中,“标准首仿药品:指生产企业为首家取得国家药品生产批准文号,同时为该药品的质量标准起草单位,并持有新药证书的国产药品"。 首仿的概念,只能以各省市招标方案为准。在各省招标方案中,大部分地区并未将首仿划分到某质量层次中,提及首仿的还是少数省份。
3、原研药:即指原创性的新药,经过对成千上万种化合物层层筛选和严格的临床试验才得以获准上市。需要花费15年左右的研发时间和数亿美元,目前只有大型跨国制药企业才有能力研制。在我国,指主要药效成分化合物在中国境内专利过期的专利药品和同类药品(未能申请在中国专利保护,但在国内首次上市的药品)。
4、 仿制药:是指与商品名药在剂量、安全性和效力(不管如何服用)、质量、作用以及适应症上相同的一种仿制品(copy)。
我国大多数药厂是小药厂,资金短缺,无法负担开发新药的费用,只能仿制。据统计,我国5400余个药厂基本每个都是以仿制药为主,市场上应用的仿制药占97%。仿制药是以原研药为蓝本,药品成分、适应证、剂量等都模仿原研药的仿制品。首先,由于原研药在申报专利时,核心的工艺部分可以保密的,所以仿制药不可能100%和原研药一样。
5、专利药品:凡申请专利的新化学单体药为专利药(中药没有专利,因为没有化学单体),它研制过程包括发现阶段、临床前开发、新药临床前申请(IND)、新药临床试验I期、新药临床试验Ⅱ期、新药临床试验Ⅲ期、新药申请(NDA)。
(1)药物组合物专利药品(化学药):仅指两种及以上有效成分或者药材的全新组合。不包括以有效成分和制剂辅料、溶媒等辅助成分构成的组合物,也不包括以改变配比为特征实施保护的组合物专利。如湖北朗天的奥拉西坦注射液,如下图
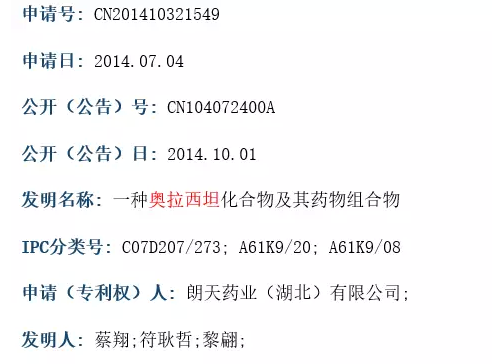
(2)天然提取物专利药品(化学药):指首次从自然界分离或提取出来的物质的保护专利,该物质结构、形态或者其它物理化学参数等应在其专利文件中被确切地表征。
(3)微生物及其代谢专利药品(化学药):指对细菌、放线菌、真菌、病毒、原生动物、藻类等微生物种经过筛选、突变、重组等方法得到并分离的纯培养物和其代谢物质的保护专利。
6、获得国家级奖项的药品:获得国家自然科学二等奖或国家科技进步二等奖及以上奖项的药品,奖项内容跟药品质量相关,不包括获得上述奖项的通用技术和其他通用研究成果的药品。
7、欧美认证药品:指获得美国FDA认证证书或欧盟CGMP认证证书的制剂生产线生产,且已向相应国家出口的国产药品(不包括原料药)。 国内通过国际认证的厂家也是越来越多,如亚宝、江苏豪森、珠海联邦等通过了美国cGMP ,常州制药厂、山东绿叶深圳市海滨等通过了欧盟GMP等,生产厂家通过了某种国际认证并不能直接出口,如需出口还必须重新地在国外申报临床等,因此在药品招标时,越来越严格,不仅提供相应的认证证书还要提供出口销售的相关单据才能进行加分。
8、独家剂型和独家规格:相信独家剂型和规格的含义大家都知道,根据70号令的意见,独家品种之外的独家剂型和独家规格(尤其一些奇异规格)要面临残酷的差比,选择标准品后,按照一定的公式进行规格和剂型的差比。(由差比规则可以看到化药中缓释剂型可以免于差比,中药中注射剂粉针、水针可以免于差比)
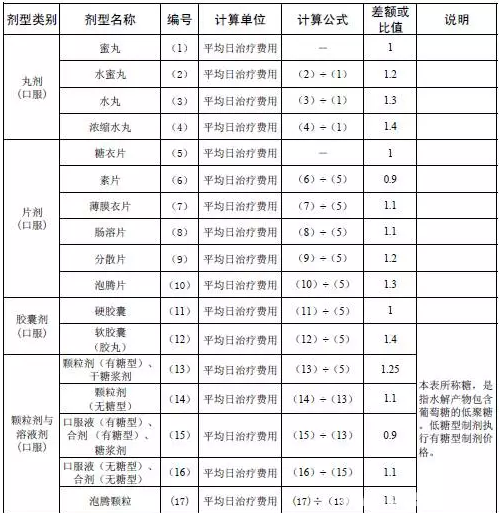
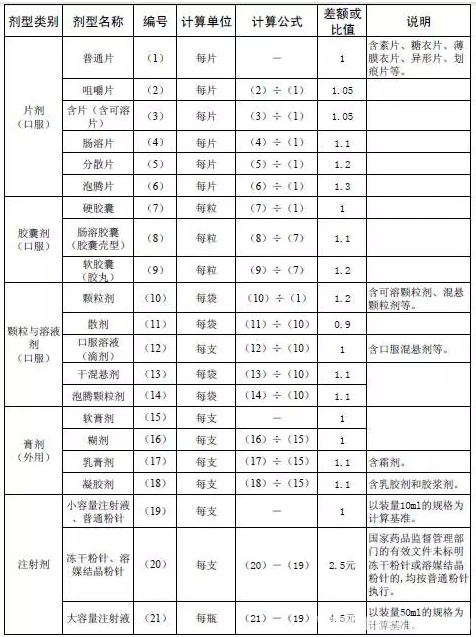
9、百强企业:参考《2014年中国医药统计年报》中《医药工业企业主管业务收入排序》排名在前100为企业生产的药品及2014年度在江苏省医疗机构网上集中采购金额排名前100位生产企业的药品。
招标来临之际,在各个战场上应该熟知本品和同类竞品的相关情况(分组和加分选项),方能知己知彼,百战不殆。
责任编辑:露儿
-
新版医保目录8月来袭 这四类药调入呼声最高
近日,国家医保局发布《2019年国家医保药品目录调整工作方案(征求意见稿)》(以下简称《意见稿》),明确2019年医保目录调整工作分为三个阶段,即1-3月准备阶段,4-5月评审阶段(确定备选名单、遴选专家投票、确定调入调出药品名单、谈判),2019年6月常规目录发布阶段,2019年6-7月谈判阶段,2019年8月发布谈判准入目录。...
-
央视曝光药师挂证乱象 药师挂证再迎整顿潮
央视3.15晚会曝光挂证乱象,某执业药师挂证平台已无法访问,药师挂证再迎整顿潮。...
-
地板价!广东药价全省联动
3月12日,广东省人民政府官网发布《关于印发广东省改革完善医疗卫生行业综合监管制度实施方案的通知》。...
-
大批医药代表工资下降?新机会来了
目前,似乎整个行业被悲观的情绪所笼罩:曾有资深的医药代表对赛柏蓝表示,现在“悲观”是大趋势:政策压力大导致的从业环境不理想,控费背景下完不成指标,所做的产品市场空间有限…… ...
-
金额公开!全国医院用药品种、科室、药企排名
金额公开!全国医院用药品种、科室、药企排名...
-
4+7未中选药品大降价!格列卫历史最低
海发通知,4+7未中选药品降价!格列卫(100mg*60片)降至7182元,创历史最低。...
-
刚刚!3个大品种说明书被改,儿童、孕妇禁用!
刚刚!3个大品种说明书被改,儿童、孕妇禁用!...
-
刚刚!这60个药,被暂停采购(附名单)
2月27日,江西省医药采购服务平台发布《关于调整二甲双胍等药品网上采购资格的通知》,有60个药被暂停挂网资格,涉及46家药企。...
-
4+7未中选高价药,提高自负比例
4+7最新文件,未中选高价药,提高自负比例,未中选药品梯度降价。...
-
药监不放假 加班查药店!5大重点需注意
这个春节,药监没放假,重点对药店执业药师在职在岗和处方药销售进行了检查。节后整治五重点,所有药店需注意。...
-
辅助用药,再迎致命打击
近日,业内流传一份由国家卫健委药政司起草的《关于征求开展药品使用监测和临床综合评价工作通知(征求意见稿)意见的函》(以下简称《意见稿》)。...
-
通过率仅14.1%!执业药师考试创7年最低
近日,国家药监局执业药师资格认证中心发布通知,公布2018年度国家执业药师资格考试合格标准和考试结果。...





















