上半年药品注册申请总体上升 仿制申请19个品种尚无国产批文
6月新增药品注册申请继续回升,上半年总体呈上升趋势 东阳光药业在6月有3个1类新药进入CDE,科伦药业首个麻醉创新药申报临床 仿制申请中有19个品种未有国产批文,10个品种目前为独家品种 注射用帕瑞昔布钠和盐酸莫西沙星的仿制申报有扎堆迹象 诺华有两个1类新药申报临床 深圳海王医药的二甲苯磺酸萘普替尼获批临床
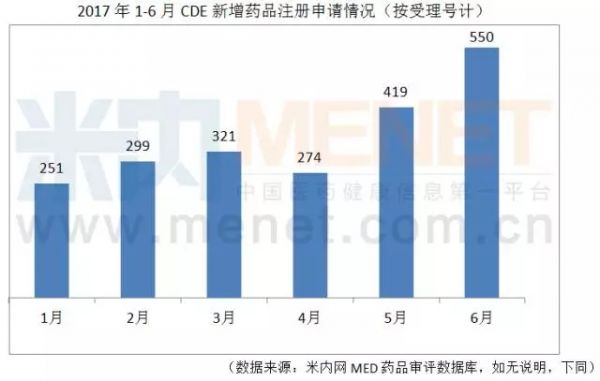
上半年药品注册申请呈上升趋势
据米内网MED药品审评数据库统计,6月份CDE新增药品注册申请550个。从总体上看,2017上半年新增药品注册申请量呈上升趋势。
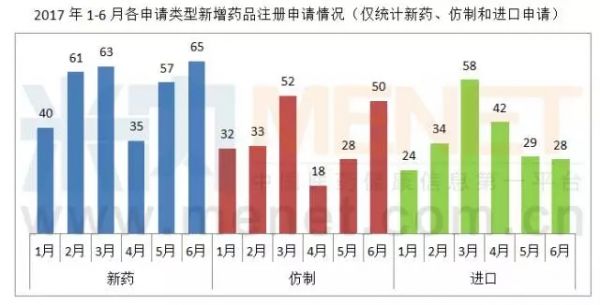
从申请类型看,6月份新药申请和仿制申请继续增加,其中仿制申请增幅较大,而进口申请基本与上月持平。
国内新药申报:东阳光3个1类新药进入CDE,科伦药业首个麻醉创新药申报临床
据米内网MED药品审评数据库,2017年6月新增新药申请65个,其中属于1类新药的申请有38个,涉及13个品种。呋喹替尼完成临床试验阶段后在本月申报生产。广东东阳光药业在6月有3个1类新药进入CDE,分别是利他匹仑原料药及其片剂,HEC74647PA原料药及其片剂和HEC68498钠盐及其片剂,但目前暂未检索到这3个品种的具体信息,加上此前3月申报的康达瑞韦钠和HEC30654AcOH,东阳光在2017上半年共有5个1类新药进入CDE。下面是6月部分新增1类新药的简介——
呋喹替尼:一种高选择性的VEGFR长效抑制剂,研发用于治疗直肠癌、非小细胞肺癌和胃癌。和记黄埔医院拥有该药的完全自主知识产权,目前该药晚期非小细胞肺癌适应症的临床研究正在进行中。
NB001:浙江永展医药申报的1类创新药,用于治疗慢性疼痛,永展医药拥有该药全球范围内的核心专利和自主知识产权。
ZSP0391:众生药业年内申报的第二个1类新药。据众生药业公告显示,ZSP0391是众生药业自2016年开始递交临床试验注册申请的第四个具有自主知识产权的小分子一类创新药。ZSP0391原料药及片剂由广东众生药业与上海药明康德共同研发,主要针对EGFR敏感突变和T790M耐药突变的非小细胞肺癌患者治疗。
KL100137:由科伦药业自主研发,是科伦药业在麻醉领域的首个创新药,同时也是继KL070002和KL-A167注射液后科伦药业年内第三个进入CDE的1类新药。非临床研究结果显示KL100137通过激活GABAa受体发挥麻醉作用,具有起效快、诱导迅速和平稳、持续输注后无蓄积、苏醒迅速、无明显呼吸和心血管抑制作用、麻醉过量可被氟马西尼逆转解救等特点,在药效和安全性方面优于丙泊酚和瑞马唑仑。


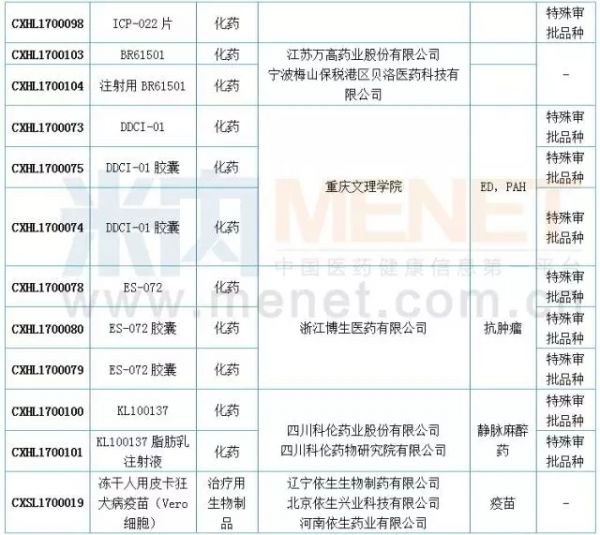
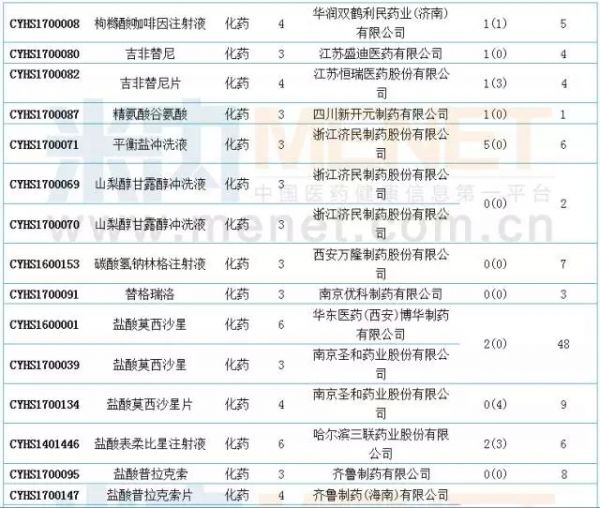
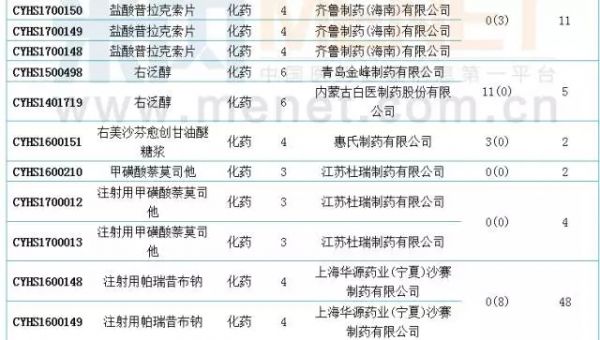
国内仿制申报:19个品种目前尚无国产批文
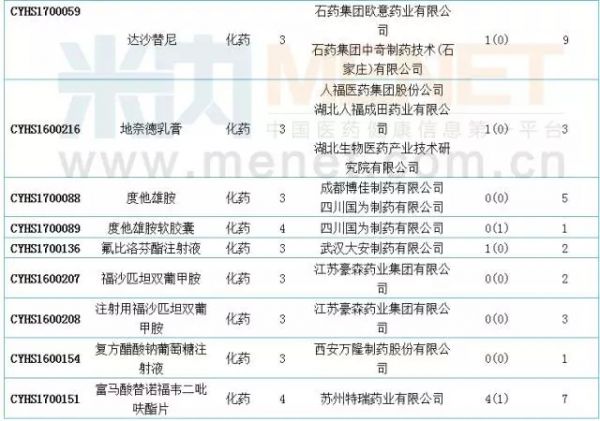
6月新增国内仿制申请50个。据米内网MID药品索引数据库统计,6月进入CDE的仿制申请中有19个品种目前尚无相关国内厂家的生产批文。此外,阿哌沙班片、安立生坦片、达沙替尼原料药、氟比洛芬酯注射液、吉非替尼原料药、精氨酸谷氨酸原料药、盐酸莫西沙星片、盐酸普拉克索片、注射用帕瑞昔布钠和注射用紫杉醇(白蛋白结合型)等10个品种目前是国内的独家品种。值得一提的是,注射用帕瑞昔布钠和盐酸莫西沙星原料药的在审受理号均达48个,有扎堆申报迹象。

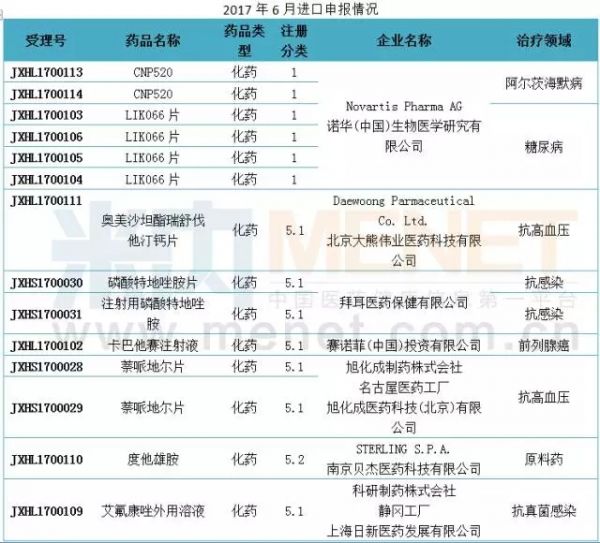
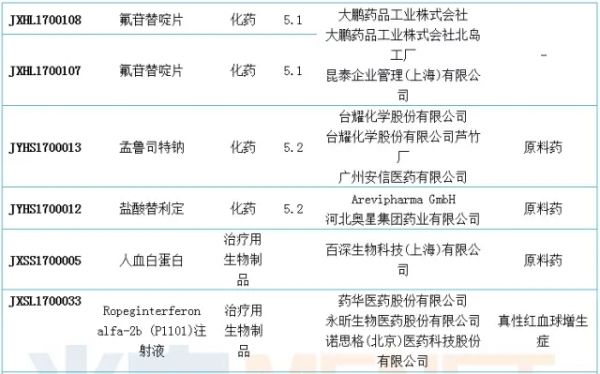
进口申报:诺华有两个1类新药申报临床
6月份CDE新增进口申请28个,涉及18个品种,以5类的申请较多。6月进口申请中有2个1类新药申报临床,均由诺华申报,分别是CNP520原料药以及LIK066片。
据悉,CNP520由诺华和安进联合开发用于治疗阿尔茨海默病,目前在国外进行临床三期研究。LIK066片是一种SGLT-2抑制剂,用于治疗2型糖尿病,该药目前在国外进行临床二期研究。

获批情况:4个1类新药获批临床
6月份有4个1类新药获批临床,分别是石家庄以岭药业的XY0206原料药及其片剂,苏州亚盛药业的APG-1252原料药及其注射剂,上海璎黎药业的YY-20394原料药及其片剂以及深圳海王医药的二甲苯磺酸萘普替尼原料药及其片剂。 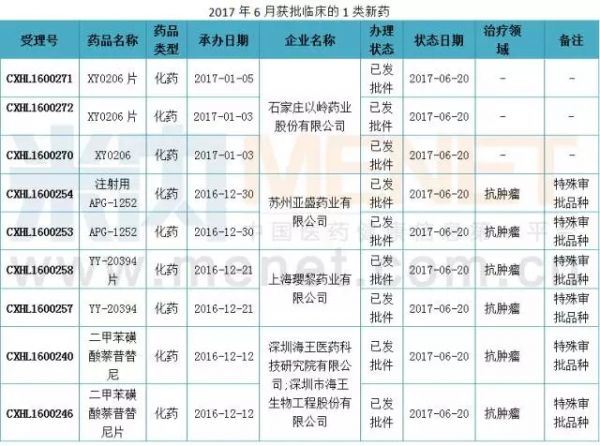
责任编辑:露儿
-
一批药被查 涉维C银翘片、阿胶…
一批药被查 涉维C银翘片、阿胶…...
-
高值耗材最高降价80% 涉雅培、波科、贝朗…
8月1日,云南省曲靖市举行高值医用耗材联盟带量集中采购第一批次中选产品企业签约仪式。...
-
国家指令 整治所有医院回扣 暗访组出发
日前,国家卫健委发布了《2020年医疗行业作风建设工作专项行动方案》,这次方案的重点就是规范医疗机构及其从业人员行为,印发给各省、自治区、直辖市及新疆生产建设兵团卫生健康委,开始组织实施。...
-
医药代表系统学习产品知识的十个步骤
每个刚入行的医药代表初期都会接受公司大量培训,产品知识培训更是重中之重,不仅培训而且还要考试。...
-
“3+6”医用耗材带量采购,价格信息公布
吉林省政府采购中心消息发布《京津冀及黑吉辽蒙晋鲁医用耗材(人工晶体类)联合带量采购文件(LH-HD2020-1)》(下称《采购文件》),公布人工晶体类耗材的具体采购品种、申报价格等信息。 ...
-
首轮价格降幅低于42% 医疗器械企业直接淘汰
首轮价格降幅低于42% 医疗器械企业直接淘汰...
-
Q1最惨淡的两大药品领域,代表都离职了!
中国虽然是世界上最先控制住疫情的国家,但随着全球疫情的爆发,输入病例不断上升,加上中国本土还有不少无症状感染患者,这使得中国经济无法完全恢复正常。...
-
某些药企又要开启新一轮裁员了
做代表难,今年更加难。除了国家级的带量采购,省级也有带量采购,感觉就像是夹缝中求生存。...
-
两家外企大裁员,患教专员全部解散!
两家外企大裁员,患教专员全部解散!...
-
执业药师挂证,面临终生逐出行业的巨大风险
执业药师挂证,面临终生逐出行业的巨大风险...
-
虚开发票2.5亿,涉多家药械企业(附目录)
近日,国家税务总局马鞍山市税务局发布的《重大税收违法案件信息公告2020年3月》显示,51家企业涉嫌虚开发票,其中24家是药械企业或相关资讯、服务企业。...
-
91家药企收入公开:以岭、科伦、康恩贝…
突如其来的新冠肺炎疫情,对中国的冲击力和冲击面都超过了2003年的非典,对中国经济乃至世界经济也产生了不可避免的影响,也严重扰乱了正常的经济运行节奏。...





















