七大中药注射剂年销40亿,千亿市场难觅新面孔
一直以来,因疗效、安全性等问题屡被诟病,中药注射剂长期处于风口浪尖。据米内网MED中国药品审评数据库2.0数据统计,最近五年,获批生产的中药注射剂新品几乎没有,而获批临床的也是少之又少,2017年仅有银杏内酯B注射液,2016年仅有注射用丹酚酸A,2015年一个都没有……
2018年1月30日,昆药集团发布公告称,该公司的中药注射剂“注射用KPCXM18”获CFDA批准临床,该产品拟用于急性缺血性脑梗患者。据悉,注射用KPCXM18是按天然药物1类新药申报,目前尚无企业获得该药品的生产批文。
中药注射剂突破中药传统的给药方式,是中药现代化的重要产物。曾经风光的中药注射剂,为何现在却深陷争议漩涡?以中药注射剂为主营业务的药企未来又将如何?
中药注射剂总规模超过千亿
心脑血管疾病用药占67%
图1:中国公立医疗机构终端中成药注射剂年度销售趋势(单位:万元)
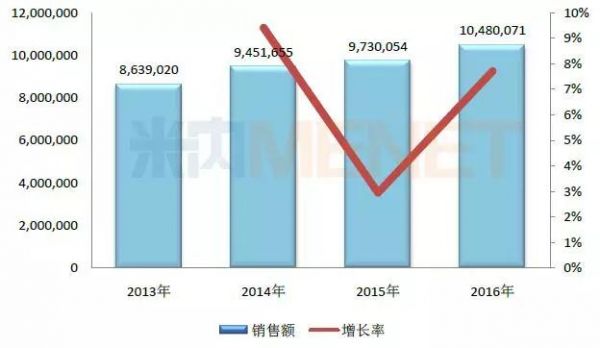
(数据来源:米内网中国公立医疗机构终端竞争格局)
据米内网数据显示,2016年中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院(简称中国公立医疗机构)终端中药注射剂的总规模超过1048亿元,其中在中国城市公立医院以及县级公立医院的市场份额合计超过八成。
图2:2016年中国公立医疗机构终端中成药13个大类的注射剂销售额占比情况
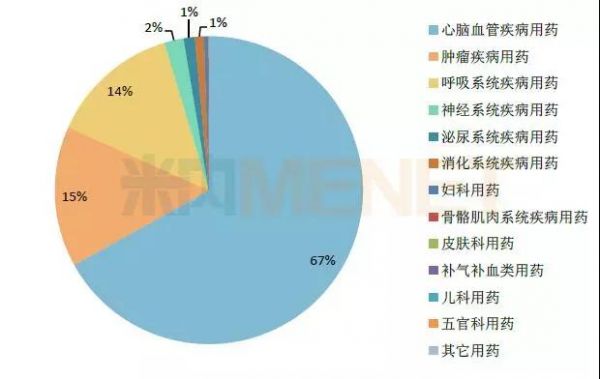
(数据来源:米内网中国公立医疗机构终端竞争格局)
在中成药市场的13个大类中,涉及注射剂的有9个,其中,心脑血管疾病用药的占比超过六成,销售额超过701亿元,肿瘤疾病用药以及呼吸系统疾病用药两个大类紧跟其后,销售额均超过100亿元。
中药注射剂TOP10产品
7个年销40亿
表1:2016年中国公立医疗机构终端中药注射剂产品TOP10(单位:万元)
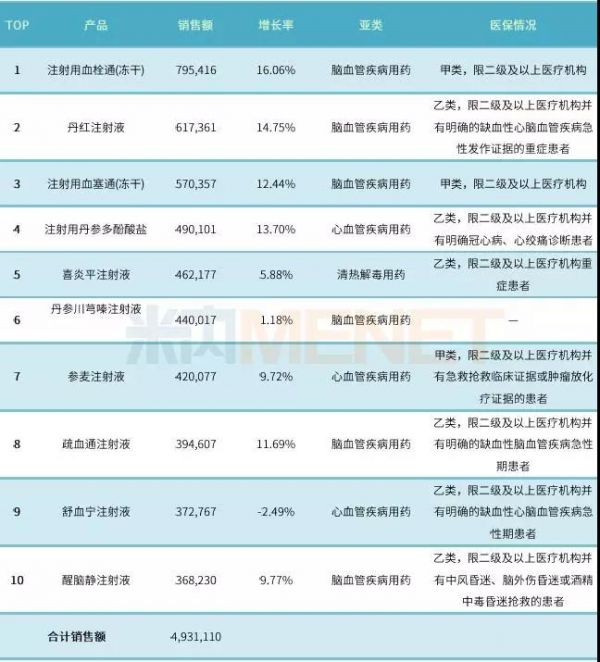
(数据来源:米内网中国公立医疗机构终端竞争格局、中国医保目录大全数据库)
数据显示,2016年中国公立医疗机构终端中药注射剂TOP10产品中有9个属于心脑血管疾病用药,细分亚类为6个脑血管疾病用药以及3个心血管疾病用药;喜炎平注射液属于呼吸系统疾病用药中的清热解毒用药。
TOP10产品合计销售额超过493亿元,销售额超过40亿元的产品有7个,除了丹参川芎嗪注射液外,其余9个均进入了新版国家医保目录。
图3:2013-2016年注射用血栓通(冻干)在中国公立医疗机构终端的销售情况(单位:万元)
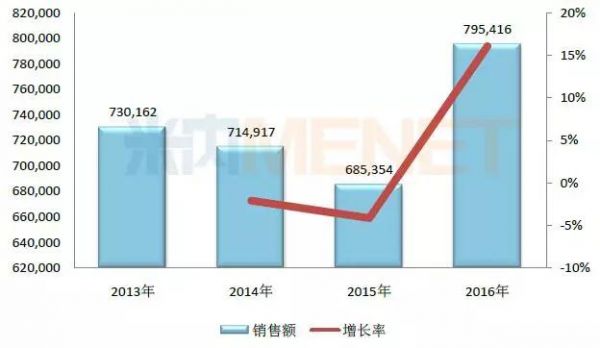
(数据来源:米内网中国公立医疗机构终端竞争格局)
注射用血栓通(冻干)是梧州制药(集团)的独家产品,用于瘀血阻络,中风偏瘫,胸痹心痛及视网膜中央静脉阻塞症,最近几年在中国公立医疗机构终端的销售额在70亿元左右。
中恒集团2016年年报中提到,新版国家医保目录中对大部分中药注射剂都加以限制使用,与其他不仅受医疗机构限制同时受病种限制的中药注射剂相比,注射用血栓通(冻干)仅受部分医疗机构的限制。本次新版国家医保目录的实施,短期内不会对公司的经营业绩造成重大影响,目前公司正在积极研究销售策略。
中恒集团表示,注射用血栓通正在开展上市后再评价工作,以天津中医药大学为首的研究团队开展物质基础、药理药效、工艺质量控制、临床疗效观测、多中心不良反应监测等项目的研究,为产品提供更加深入、全面的临床应用依据。
图4:2013-2016年丹红注射液在中国公立医疗机构终端的销售情况(单位:万元)
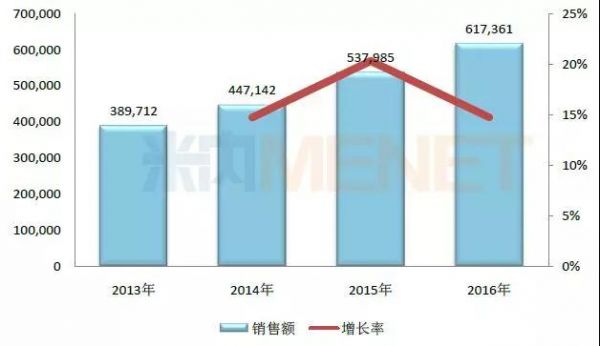
(数据来源:米内网中国公立医疗机构终端竞争格局)
丹红注射液是山东丹红制药的独家产品,用于瘀血闭阻所致的胸痹及中风,冠心病、心绞痛、心肌梗塞,瘀血型肺心病,缺血性脑病、脑血栓等的治疗。最近几年,丹红注射液在中国公立医疗机构终端的销售额逐年攀升,2016年突破了60亿元关口。
步长制药在2017年半年报中提到,目前丹红注射液的循证医学研究正在稳步进行,以挖掘产品潜力、延长产品生命周期。
图5:2013-2016年注射用血塞通(冻干)在中国公立医疗机构终端的销售情况(单位:万元)
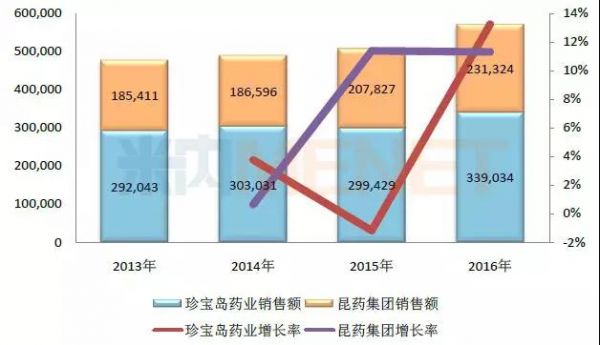
(数据来源:米内网中国公立医疗机构终端竞争格局)
注射用血塞通(冻干)用于中风偏瘫、瘀血阻络及脑血管疾病后遗症、视网膜中央静脉阻塞属瘀血阻滞证者的治疗,该产品获批生产的企业包括了珍宝岛药业和昆药集团。
在市场份额上,珍宝岛药业占六成左右,该产品最近几年的销售额在30亿元左右,目前珍宝岛药业获批的注射用血塞通(冻干)有三个规格,包括了100mg、200mg和400mg。
昆药集团的注射用血塞通(冻干)最近几年的销售额有快速增长的态势,2016年上涨至23.1亿元。目前昆药集团获批的注射用血塞通(冻干)有两个规格,包括了0.2g和0.4g。
政策不断升级
2018年启动注射剂再评价
近年来,政府层面对于中药注射剂的关注逐渐加深。2009年发布的《关于做好中药注射剂安全性再评价工作的通知》中提到,将分期分批对中药注射剂的重点品种进行风险效益评价,第一批开展风险效益评价的品种为双黄连注射剂和参麦注射剂,第二批再评价品种包括鱼腥草注射液和鱼金注射液。随后,审评审批部门对申请上市或临床的中药注射剂把关更加严格,最近几年在市场上确实难觅新品。
2017年2月,新版国家医保目录正式发布,目录中包含的49个中药注射剂中有39个受到不同程度的限制。在受限品种里,有26个限二级以上医疗机构使用,也就意味着这些受限品种失去了大部分的基层市场。
随后,CFDA宣布“要启动中药注射剂药品安全性、有效性的再评价工作”,正式传递了中药注射剂再评价将成为下一阶段的攻艰任务,并将此作为推进整体药品质量疗效工作重点之一的信号。
2017年7月1日,《中华人民共和国中医药法》正式实施,提出建立符合中医药特点的管理制度,加大对中医药事业的扶持力度,坚持扶持与规范并重,加强对中医药的监管,同时加大对中医药违法行为的处罚力度,中药注射剂的评价工作再次迎来关键环节。
2017年10月,《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》发布,提出将严格药品注射剂审评审批,中药注射剂的评价工作将大刀阔斧进行。CFDA局长毕井泉曾指出,注射剂的再评价是仿制药质量疗效评价的重要组成部分,用5—10年完成注射剂的评价工作,是中办国办印发的《意见》中提出的任务。注射剂特别是静脉注射剂,属于高风险剂型,必须严格监管。《意见》对注射剂的审评审批做了严格的限定;对过去已批准上市的注射剂,要求批准文件持有人进行成分、机理、临床疗效的研究,评价其安全性、有效性和质量可控性。总局将尽快明确注射剂再评价的方式方法和时间步骤。
2017年12月,仿制药质量与疗效一致性评价办公室发布的关于公开征求《已上市化学仿制药(注射剂)一致性评价技术要求》意见的通知,意味着落实“两办36条”中关于“开展药品注射剂再评价”启动的第一步。
2018年1月,在北京召开的全国食品药品监督管理暨党风廉政建设工作会议上,强调2018年食品药品监管工作重点要做好八个方面的工作,其中包括了启动注射剂再评价工作,推进仿制药质量和疗效一致性评价,建立企业直接报告不良反应制度等。
政策不断升级,且步步紧迫,审批愈趋严格,市场难觅新品。一些在市场上经历了多年打拼,成为“一方霸主”的大品种中药注射剂,已经有了庞大的患者群体与口碑支持,若能顺利通过“再评价”这一关,把有效性和安全性堂堂正正地展现出来,这个千亿市场在汰弱留强后,必定会给予这些强者更大的回报。而作为中药现代化的重要产物,中药注射剂想要走出国门冲向世界,也将更有说服力。
资料来源:米内网数据库、上市公司公告、医药经济报
责任编辑:露儿
-
一批药被查 涉维C银翘片、阿胶…
一批药被查 涉维C银翘片、阿胶…...
-
高值耗材最高降价80% 涉雅培、波科、贝朗…
8月1日,云南省曲靖市举行高值医用耗材联盟带量集中采购第一批次中选产品企业签约仪式。...
-
国家指令 整治所有医院回扣 暗访组出发
日前,国家卫健委发布了《2020年医疗行业作风建设工作专项行动方案》,这次方案的重点就是规范医疗机构及其从业人员行为,印发给各省、自治区、直辖市及新疆生产建设兵团卫生健康委,开始组织实施。...
-
医药代表系统学习产品知识的十个步骤
每个刚入行的医药代表初期都会接受公司大量培训,产品知识培训更是重中之重,不仅培训而且还要考试。...
-
“3+6”医用耗材带量采购,价格信息公布
吉林省政府采购中心消息发布《京津冀及黑吉辽蒙晋鲁医用耗材(人工晶体类)联合带量采购文件(LH-HD2020-1)》(下称《采购文件》),公布人工晶体类耗材的具体采购品种、申报价格等信息。 ...
-
首轮价格降幅低于42% 医疗器械企业直接淘汰
首轮价格降幅低于42% 医疗器械企业直接淘汰...
-
Q1最惨淡的两大药品领域,代表都离职了!
中国虽然是世界上最先控制住疫情的国家,但随着全球疫情的爆发,输入病例不断上升,加上中国本土还有不少无症状感染患者,这使得中国经济无法完全恢复正常。...
-
某些药企又要开启新一轮裁员了
做代表难,今年更加难。除了国家级的带量采购,省级也有带量采购,感觉就像是夹缝中求生存。...
-
两家外企大裁员,患教专员全部解散!
两家外企大裁员,患教专员全部解散!...
-
执业药师挂证,面临终生逐出行业的巨大风险
执业药师挂证,面临终生逐出行业的巨大风险...
-
虚开发票2.5亿,涉多家药械企业(附目录)
近日,国家税务总局马鞍山市税务局发布的《重大税收违法案件信息公告2020年3月》显示,51家企业涉嫌虚开发票,其中24家是药械企业或相关资讯、服务企业。...
-
91家药企收入公开:以岭、科伦、康恩贝…
突如其来的新冠肺炎疫情,对中国的冲击力和冲击面都超过了2003年的非典,对中国经济乃至世界经济也产生了不可避免的影响,也严重扰乱了正常的经济运行节奏。...





















