全球TOP10药企在华临床试验 谁申报最多?
对于医药人来说,“5.20”应当具备一个更不一样的色彩。跨国药企在华临床试验,谁申报最多?谁完成最多?谁撤回最多?为什么?答案都在这篇文章里。
一年一度的“5.20”,今年你是如何度过的?是否已经沉浸在甜言蜜语之中无法自拔,是否已经拿到了心仪的礼物,是否又向你身边所爱的人,你的父母、爱人、子女,大声的说出“我爱你”这三个字?
对于医药人来说,“5.20”应当具备一个更不一样的色彩。今年的5.20已经是第十四个国际临床实验日。1947年5月20日,苏格兰海军军医Lind进行了坏血病临床试验,被认为开创了临床试验的先河。为纪念这一历史性事件,欧洲临床研究基础网络联合美国和加拿大,提议将每年的5月20日定为国际临床试验日。2005年5月20日成为了第一个国际临床试验日。
作为新药开发流程中的重要一环,药品临床试验的重要性自然无需赘言。不光药品的最基本属性——有效性及安全性最终都需要依靠其来进行检验,临床试验的进行还为医生和病人正确使用新药提供依据,药品的适应证、剂量、给药途径、剂型和配方、个体使用差异、禁忌症、耐药性、抗药性及其他影响因素等都依赖于临床试验来确定信息。
对于制药企业来说,临床试验的具体开展情况,例如患者招募的成功与否,临床实验基地的配合与否,临床试验效果的理想与否,都直接决定了其药品能否按照预期成功上市。
在5.20国际临床试验日这一天,我们统计了全球TOP10制药企业(排名依据2017年制药经理人全球制药企业50强名单)当前在中国开展临床试验的整体情况。这其中,既有当下正在进行状态中的临床试验,亦包括已经完成的临床试验。除此之外,绝大多数企业还都存在此前申报但后来因种种原因主动暂停临床实验的情况。
在华申报:诺华是绝对大佬
根据美国《制药经理人》(Pharmaceutical Executive)一年一度的全球制药企业50强排名,2017年全球制药企业TOP10分别为辉瑞、诺华、罗氏、默克、赛诺菲、强生、吉利德科学、葛兰素史克、艾伯维、安进。由于该排名仅就全球制药企业上年度的处方药销售额进行排名,不加入市值和消费品业务等参考值,因此更接近于制药企业真正实力的展现。
但同样是TOP10制药企业,反映在在华临床试验申报上,其表现却相差甚远。
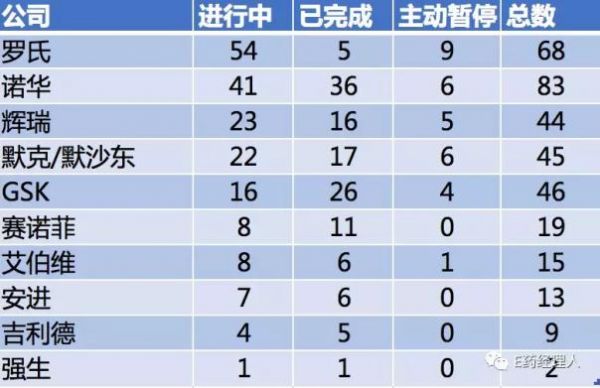
从数量上看,在华申报临床试验数量最多的,是来自瑞士的诺华。在药物临床试验登记与信息公示平台上检索可得,在所有可查的记录中,诺华一共申报了83项临床试验,其中41项临床试验正在进行之中,36项已经完成,此外还有6项处于主动暂停状态。
而在41项正在进行的临床试验之中,有11项患者已经招募完成。这些项目除了一项尚处于临床II期之外,其余绝大部分都为临床III期或新药上市后的IV期阶段,且均为国际多中心临床试验。
数量在诺华之后的,则是罗氏。在所有可查的记录中,罗氏一共申报了68项临床试验,正在进行的则有54项,是所有TOP10制药企业中正在进行临床试验最多的企业。其中,罗氏继曲妥珠单抗(赫赛汀)之后的另一个重磅靶向药帕妥珠单抗也在其中。此前,罗氏已经向CFDA提交了上市申请,并且获得了优先审评的资格,当前该药已处于III期临床状态,也是所有的临床中进展相对较快的一个。
排在第三位的是辉瑞。尽管在《制药经理人》的排名中辉瑞力压诺华位于榜首,但从在华申报的临床试验数量来看,不管是正在进行的还是已经完成的都较诺华有不小的差距。其当前共有23项临床试验正在进行之中,16项临床试验已完成。
此外据了解辉瑞2018年在中国还有至少两项重磅的临床试验在进行,一个是比较他克莫司胶囊和环磷酰胺注射剂治疗狼疮性肾炎的疗效和安全性的III期随机开放平行对照多中心研究,而在这一临床试验背后,则是一个高达30亿美金的全球市场。另一项则是比较利妥昔单抗联合来那度胺(CC-5013)与利妥昔单抗联合安慰剂治疗复发性/难治性惰性淋巴瘤疗效和安全性的随机、双盲、III期临床研究。
而再往下,各家制药企业在华正在进行的临床试验数量相对来说就要逊色不少。默克/默沙东一共有22项临床试验正在进行,基本上与辉瑞一致,GSK则只有16项。赛诺菲、艾伯维、安进、吉利德科学、强生则均在10项以下。
TOP10制药企业在华临床试验申报情况
两大挑战
必须要注意的是,除少数企业之外,绝大多数跨国药企在华临床试验申报都存在“主动暂停”的情形。在这一方面,罗氏最多,为9起。当然这同其总数较多也有一定的关联。其次是诺华和默克,分别有6个临床试验被主动暂停。
从具体的原因来看,缺乏疗效或是风险获益比不够理想是绝大多数临床试验被暂停的重要原因。举例来看,罗氏主动暂停的9起临床试验均归属于此类情形。例如其用于发生急性冠脉综合征的2型糖尿病患者的药物Aliglitazar,其试验数据显示有效性不充分,且结合其他安全性信号发现,认为其总体的风险获益比不够理想,罗氏便主动暂停了该临床试验。
事实上,这种情况是新药研发环节中的常态。新药研发的风险与不易已经众所周知,而也正因此,近年来跨国药企也在不断调整或裁撤其既有的研发管线,从而将视线集中至更有希望成药的领域,例如辉瑞公司已经表示将停止阿尔茨海默及帕金森症治疗药物的发现与研究,GSK也已经将其在中国的神经系统药物全球研发中心正式关闭。
而另外一方面,临床试验的患者招募是一个比较大的问题。
尽管当前中国越来越被纳入国际多中心临床试验的范畴之中,但患者的招募仍然是一个挑战。例如强生一款用于动脉粥样硬化的药物ACZ885,其计划入组总体为10000人,中国140人,但最后实际入组10105人,中国则为126人,未达到原定的入组计划。再如其另外一款用于治疗局部晚期或转移性乳腺癌的BKM120的临床试验,其已经进行到三期阶段,计划目标入组人数为总体1060人,中国150人,但实际入组总人数达标为1130人,但中国患者入组的仅有47人,尚不足计划入组人数的三分之一。
但除此之外,也有一些比较特殊的主动暂停案例。例如辉瑞此前申报了其用于治疗高血压、冠心病药物的苯磺酸氨氯地平片(络活喜)的生物等效性试验/生物利用度试验,但2017年12月29日,该产品在CFDA网站被公示为原研地参比制剂,因此确认仿制药一致性评价BE试验已被批准豁免,该试验也顺势被主动终止。
国际多中心:增长爆点已现
根据药物临床试验登记与信息公示平台的统计信息,截至2018年5月20日,共有8396项临床试验在该平台登记。
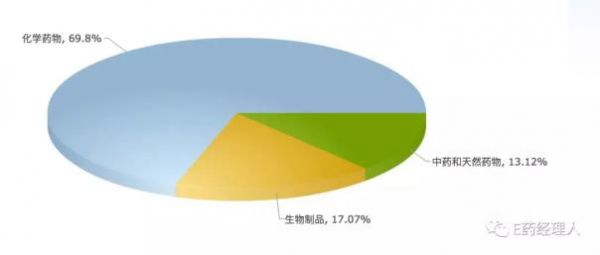
从目前的情况来看,化学药物仍然占据着临床试验的绝对比例,为69.8%,其次则为生物制品,为17.07%,中药和天然药物最少,为13.12%。
而从临床试验的性质来看,绝大多数申报的临床试验仍然是国内试验,占比91.06%,而国际多中心临床试验只占8.94%。

但一个必然的趋势是,未来的临床试验申报,生物制品的占比一定会逐渐增大,而国际多中心临床试验的占比也将会继续增多。
之所以如此,一方面是因为生物制品已经逐渐成为跨国药企以及国内本土创新企业产品线中的重要组成部分。不管是从前两年火热的PD1/PD-L1,还是当下正火爆的CAR-T疗法等,每一轮新概念的出现都催生出一批生物药公司,并引发出临床申报的新浪潮。
而随着中国加入ICH,中国在药品研发体系以及注册国际化道路上已经开始与国际水平接轨。越来越多的跨国公司更加重视中国市场,且不再为繁琐的审批手续以及漫长的时间而担心。在这一层面而言,越来越多的将中国纳入国际多中心试验的范畴只是一个必然。
责任编辑:露儿
-
一批药被查 涉维C银翘片、阿胶…
一批药被查 涉维C银翘片、阿胶…...
-
高值耗材最高降价80% 涉雅培、波科、贝朗…
8月1日,云南省曲靖市举行高值医用耗材联盟带量集中采购第一批次中选产品企业签约仪式。...
-
国家指令 整治所有医院回扣 暗访组出发
日前,国家卫健委发布了《2020年医疗行业作风建设工作专项行动方案》,这次方案的重点就是规范医疗机构及其从业人员行为,印发给各省、自治区、直辖市及新疆生产建设兵团卫生健康委,开始组织实施。...
-
医药代表系统学习产品知识的十个步骤
每个刚入行的医药代表初期都会接受公司大量培训,产品知识培训更是重中之重,不仅培训而且还要考试。...
-
“3+6”医用耗材带量采购,价格信息公布
吉林省政府采购中心消息发布《京津冀及黑吉辽蒙晋鲁医用耗材(人工晶体类)联合带量采购文件(LH-HD2020-1)》(下称《采购文件》),公布人工晶体类耗材的具体采购品种、申报价格等信息。 ...
-
首轮价格降幅低于42% 医疗器械企业直接淘汰
首轮价格降幅低于42% 医疗器械企业直接淘汰...
-
Q1最惨淡的两大药品领域,代表都离职了!
中国虽然是世界上最先控制住疫情的国家,但随着全球疫情的爆发,输入病例不断上升,加上中国本土还有不少无症状感染患者,这使得中国经济无法完全恢复正常。...
-
某些药企又要开启新一轮裁员了
做代表难,今年更加难。除了国家级的带量采购,省级也有带量采购,感觉就像是夹缝中求生存。...
-
两家外企大裁员,患教专员全部解散!
两家外企大裁员,患教专员全部解散!...
-
执业药师挂证,面临终生逐出行业的巨大风险
执业药师挂证,面临终生逐出行业的巨大风险...
-
虚开发票2.5亿,涉多家药械企业(附目录)
近日,国家税务总局马鞍山市税务局发布的《重大税收违法案件信息公告2020年3月》显示,51家企业涉嫌虚开发票,其中24家是药械企业或相关资讯、服务企业。...
-
91家药企收入公开:以岭、科伦、康恩贝…
突如其来的新冠肺炎疫情,对中国的冲击力和冲击面都超过了2003年的非典,对中国经济乃至世界经济也产生了不可避免的影响,也严重扰乱了正常的经济运行节奏。...





















