国采趋势明朗步步紧逼:原研药企、仿制药企立项必读
五批集采趋势
企业均分采购量递减
五批集采下来,入围企业确定准则基本固化。
从采购品种目录中同品种最多入围企业情况看,第五批和第四批规则基本一致。
从中标率看,符合“申报品种资格”的实际申报企业数在1家、2家、5家、10家和11家时,中标率在80%以上。
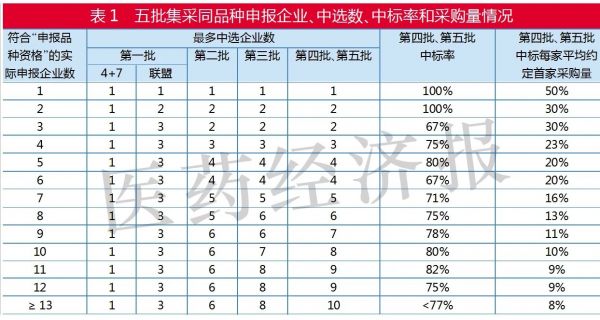
鉴于各品种各地首年约定采购量的规则,全国实际中选企业数为1家的,为首年约定采购量计算基数的50%;全国实际中选企业数为2家的,为首年约定采购量计算基数的60%;全国实际中选企业数为3家的,为首年约定采购量计算基数的70%;全国实际中选企业数为4家及以上的,为首年约定采购量计算基数的80%。
若按照中标企业数平分约定采购量计算基数的份额,随着中标家数的增加,每家企业均分到的采购量是在递减的。
5家申报4家中标者回报最高
根据国家集中采购的规则,全国实际中选企业数为1家或2家的,本轮采购周期原则上为1年;全国实际中选企业数为3家的,本轮采购周期原则上为2年;全国实际中选企业数为4家及以上的,本轮采购周期原则上为3年。鉴于全国集采往往只招一轮,集采完之后就要回归到各个省份或省级联盟,招标采购周期越长,企业的成本越低。
综合上述因素,实际申报企业数5家的产品如果能4家中标,企业的回报最高。
进口药企如何变道?
进口原研药企中标率下降
第一批“4+7”25个中标产品中仅2个是进口原研药,为施贵宝的福辛普利钠片和阿斯利康的吉非替尼片,中标率为8%。
联盟地区集中带量采购中,进口原研药企赛诺菲的硫酸氢氯吡格雷片和厄贝沙坦氢氯噻嗪片、阿斯利康的吉非替尼片、默沙东的孟鲁司特钠片、礼来的注射用培美曲塞二钠、施贵宝的福辛普利钠片中标,中标率为24%。
第二批32个中标产品中,进口原研药企有4个产品,分别是勃林格殷格翰的美洛昔康片、拜耳的阿卡波糖片及盐酸莫西沙星片、新基的注射用紫杉醇(白蛋白结合型),中标率为25%。
第三批55个中标产品中,进口原研药企产品有辉瑞的利奈唑胺片、UCB的左乙拉西坦注射用浓溶液、卫材的甲钴胺片,中标率为5.45%。
第四批45个中标产品,进口原研药企中标有赛诺菲的氨磺必利片和费森尤斯卡比的丙泊酚中/长链脂肪乳注射液2家,中标率为4.44%。
卖专利过期原研产品线
进口原研药企的中标率在下降,意味着大部分进入集采的药品的进口原研药企丢标。丢标的结果是,这些外企在医院终端的原有市场规模被挤压。即使进口原研药企积极争夺国内企业在零售药店的市场份额,但根据零售药店销售数据,在零售药店增长的业绩并不能填补因集中带量采购丢失的市场。
进口原研药企营销团队的规模是与业绩挂钩的,产品的业绩下滑,意味着进口原研药企的营销团队会收缩,要么几个产品线合并,要么将产品线卖给国内企业。
接现有优势领域产品的代理
带量采购实施后,进口原研药企的优势领域在创新药,特别是肿瘤新药。进口药企具备丰富的专家资源和强大的产品市场规划能力,拥有专业的推广团队和医院开发能力,但总部可以上市的新药数量是有限的。因此,在自己的优势领域寻找自有产品没有的靶点的非竞争产品以丰富产品线,是进口药企的需求。
对于国内的创新药企业来说,随着加快审评审批等利好政策的实施,同一靶点的肿瘤创新药在短时间内上市四五家会是常态。没有营销资源的国内创新药企业面临投资方要求尽快盈利的压力,也面临在二级市场上市的发展需求,于是国内创新药企业在产品上市后有业绩快速增长放量的需求。而目前在我国能够玩转首推药的国内企业并不多,只有恒瑞、豪森、扬子江、正大天晴等大企业,积累多年才能在新药上市后立刻打开局面。如果国内创新药企业从“零”开始建队伍,预计要交不少“学费”。
而未来,进口药企承接国内创新药企业的产品代理的案例将越来越多。进口药企将成立产业基金,通过基金方式投资国内创新药企业,并获得相关产品的全国或部分省份的市场权益。国内创新药企业如果能在二级市场上市,那么该基金还能通过IPO渠道实现退出,从而获得资本方面的回报。
仿制药企七大关注点
对于国内仿制药企业来说,集中采购的好处是准入上的成本利好。生产厂家只需关注生产,只要价格有优势、在集中采购中中标即可。
01、一致性评价政策的执行情况?
目前有几项政策让国内仿制药企业在做立项决策时仍存顾虑,主要涉及国内推动一致性评价利好政策的执行情况:
①已有3家企业过评后,医院采购不再选择未通过一致性评价的该产品厂家。那么这个产品是指医保目录凡例的统一剂型,还是指这个产品所对应的剂型?
②2007年以前国内已上市的产品,必须在首家一致性评价获批的三年内申报一致性评价,否则不予申报且到期不予再注册。一方面,注射剂、滴眼液这类产品可能面临新注册分类获批上市等同通过一致性评价,但该剂型迟迟未启动一致性评价,三年内可能完成不了一致性评价,需要申报延期。另一方面,个别口服固体制剂厂家在首家一致性评价获批的三年后依然能够申报一致性评价。
③不同剂型之间将进行差比价,而差比价并没有完全将独特剂型和原研剂型的价格区分开,这大大打压了国内企业立项改良药。
④省集采究竟是延续国家集采的结果还是最低价中标?如果延续国家集采的结果,对于后面获批一致性评价的厂家不公平;如果是最低价中标,那么一个省1家中标是否应该只占50%市场?如果是十多个省的联盟采购,是否应该采取国采多家中标的方式,而非独家中标?或者国采再采一次?而一些需求量或产量要求非常大的产品,独家中标可能有供应风险。
02、是否已经进入国采,且在研厂家多?
从现有的结果看,仿制药企业必须在该产品第一次进入国家集采目录时获批一致性评价并获得国家集采的准入资格,才能保证利益最大化。因此,已经进入国家集采目录的产品,除非在研厂家非常少,否则没有多大的立项价值。
03、独家过评,营销能力够不够强?
独家通过一致性评价的厂家,虽然能挂网采购,但没有像集中带量采购那样的准入利好政策。对于营销能力不强的生产厂家来说,即使首家获批过评了,市场也难以打开局面,也难以争夺专利过期原研药企的市场,短期内难以替代专利过期原研药企。
04、专利挑战成功,能否抢到原研药份额?
引申到我国即将执行的专利挑战制度,虽然国内专利挑战成功的药企有一年独占期,但如果只有原研药和1家仿制药上市,仍达不到启动集采的条件。若这家仿制药企业没有强大的营销团队,预计也抢不到多少专利过期原研药的市场。
那么,未来专利挑战可能出现两种情况:一是该产品领域具备营销实力的厂家去抢首仿并享有一年的专利独占期,通过其营销能力争夺原研药企的市场;二是几家企业联合去做专利挑战,并且同时获批,凑成集采启动的条件,抢第一次的集采机会。
05、降成本,尤其要考虑原辅包可及性
国内仿制药企业赢得集采的关键是成本。仿制药的生产成本主要是原辅料包材的成本,以及制剂的生产成本。制剂的生产成本未来会通过固定资产的升级改造——提高收率、减少损耗等,比如工艺可能改造成直接压片的模式来降低成本。MAH模式并不能解决成本问题:一来合作方的加工报价往往包括对方的项目管理成本,价格会偏高;二来生产排期由委托生产方控制的,集采中标后可能会出现多家厂家都急着委托生产方加急生产的情况,而加急生产就会面临委托生产方趁机提价,上市许可持有人可能面临不能如期发货的风险。
上市许可持有人需要特别注意的难题是:集采中标后原有合作的原辅料包材合作厂家可以趁机提价;或者原辅料出现市场垄断情况,导致厂家的生产难以持续。拥有原料药的生产厂家为了提高自己在价格方面的竞争优势,在原料供应给国内其它竞争厂家时报价也会偏高。
因此,仿制药立项最核心最关键的考量就是原辅料的可及性问题;其次是核算整个生产成本,与欧美日的仿制药的销售价格比较,看有无成本优势。此外,项目可行性方面,要看首家申报的进度和自己的研发团队的效率,如果要争国采的首次招标资格,那么与首家申报之间的时间差不要太长。
06、需求很大的产品,过评产能不够怎么办?
值得注意的是,集采政策下,各个厂家对通过一致性评价的产品相关的固定资产的投入会非常慎重。对于目前市场需求量或销售量非常大的一些产品,通过一致性评价的厂家可供应的量未必能够满足现有的市场需求;而未通过一致性评价的产品退出院内采购市场后,如何保障用药?
07、转战OTC,可布局的方向?
不少国内仿制药企业开始将立项方向往OTC考虑,因为药品零售端销售为主的产品受集采影响相对较少。
然而,我国注册法规提到的OTC豁免BE研究优化上市的注册路径迟迟未发布,短期内OTC产品的仿制药还是要走BE,而不少OTC是没有参比制剂的“祖父药”,国内仿制药企业可布局选择的方向并不多。咸达药海遨游数据显示,截至2021年5月31日,我国NMPA数据库收集了272个双跨的化学药产品,其中OTC甲类有196个,以消化、感冒、非甾体消炎等药品为主。
小结<<<
国家集中带量采购结束后,究竟是延续国标还是省级带量采购?二者不能同步执行,相较于省级带量采购独家中标,国家带量集中采购更利好于国内仿制药企业。仿制药立项最关键的是计算成本,如何提升从研发到生产体系的整个系统的效率、从而达到成本管控的目的,是仿制药企业需要攻克的难题。
责任编辑:露儿
-
一批药被查 涉维C银翘片、阿胶…
一批药被查 涉维C银翘片、阿胶…...
-
高值耗材最高降价80% 涉雅培、波科、贝朗…
8月1日,云南省曲靖市举行高值医用耗材联盟带量集中采购第一批次中选产品企业签约仪式。...
-
国家指令 整治所有医院回扣 暗访组出发
日前,国家卫健委发布了《2020年医疗行业作风建设工作专项行动方案》,这次方案的重点就是规范医疗机构及其从业人员行为,印发给各省、自治区、直辖市及新疆生产建设兵团卫生健康委,开始组织实施。...
-
医药代表系统学习产品知识的十个步骤
每个刚入行的医药代表初期都会接受公司大量培训,产品知识培训更是重中之重,不仅培训而且还要考试。...
-
“3+6”医用耗材带量采购,价格信息公布
吉林省政府采购中心消息发布《京津冀及黑吉辽蒙晋鲁医用耗材(人工晶体类)联合带量采购文件(LH-HD2020-1)》(下称《采购文件》),公布人工晶体类耗材的具体采购品种、申报价格等信息。 ...
-
首轮价格降幅低于42% 医疗器械企业直接淘汰
首轮价格降幅低于42% 医疗器械企业直接淘汰...
-
Q1最惨淡的两大药品领域,代表都离职了!
中国虽然是世界上最先控制住疫情的国家,但随着全球疫情的爆发,输入病例不断上升,加上中国本土还有不少无症状感染患者,这使得中国经济无法完全恢复正常。...
-
某些药企又要开启新一轮裁员了
做代表难,今年更加难。除了国家级的带量采购,省级也有带量采购,感觉就像是夹缝中求生存。...
-
两家外企大裁员,患教专员全部解散!
两家外企大裁员,患教专员全部解散!...
-
执业药师挂证,面临终生逐出行业的巨大风险
执业药师挂证,面临终生逐出行业的巨大风险...
-
虚开发票2.5亿,涉多家药械企业(附目录)
近日,国家税务总局马鞍山市税务局发布的《重大税收违法案件信息公告2020年3月》显示,51家企业涉嫌虚开发票,其中24家是药械企业或相关资讯、服务企业。...
-
91家药企收入公开:以岭、科伦、康恩贝…
突如其来的新冠肺炎疫情,对中国的冲击力和冲击面都超过了2003年的非典,对中国经济乃至世界经济也产生了不可避免的影响,也严重扰乱了正常的经济运行节奏。...





















