- 数据反映了产品组合与研发管线中新洞见和精准肿瘤学的进展 –
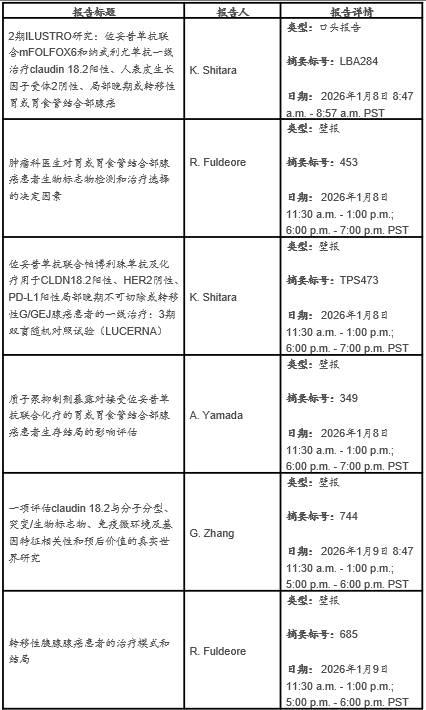
- 2期ILUSTRO研究评估佐妥昔单抗三药联合方案用于一线晚期胃癌和胃食管结合部(G/GEJ)癌的队列结果入选最新突破性口头报告 -
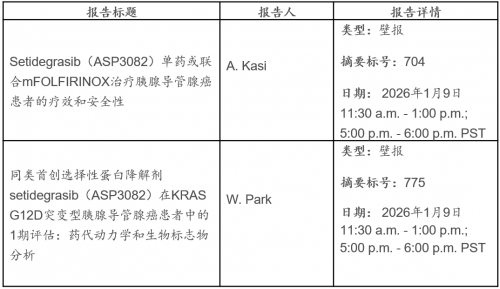
东京,2025年12月11日—安斯泰来制药公司(TSE: 4503,总裁兼首席执行官:冈村直树,"安斯泰来")今日宣布,将于2026年美国临床肿瘤学会胃肠道癌症研讨会上(ASCO GI),公布胰腺癌和胃/胃食管结合部(G/GEJ)癌潜在新疗法的数据。亮点包括获选进行最新数据口头报告的评估佐妥昔单抗联合化疗及免疫疗法一线治疗claudin 18.2阳性、HER2阴性局部晚期或转移性G/GEJ肿瘤的2期ILUSTRO研究的队列结果;以及新型KRAS G12D靶向蛋白降解剂ASP3082(setidegrasib)治疗胰腺癌的1期研究新数据。ASCO GI 于2026年1月8日至10日在加利福尼亚州旧金山举行。
安斯泰来肿瘤研发负责人、工商管理硕士、Moitreyee Chatterjee-Kishore博士
"在安斯泰来,我们正利用新一代治疗方法,以及基于精准生物标志物的研发策略,致力于为胃肠道癌症患者提供真正有意义的治疗方案。我们非常高兴能在 ASCO GI 学术会议上分享我们不断扩展的胃肠道癌症研发成果——这些成果体现了我们不断深入探索如何更有效治疗此类疾病的承诺,其中包括关于佐妥昔单抗的最新研究数据,以及 针对在研 KRAS G12D靶点蛋白降解剂ASP3082(setidegrasib)的研发进展。与充满热忱的胃肠道癌症患者、医生和倡导者社区携手,我们正努力改写患者的治疗结局,引领癌症治疗的未来。"
安斯泰来在2026年ASCO GI的报告
威络益(佐妥昔单抗)
ASP3082 (setidegrasib)
关于安斯泰来
安斯泰来是一家全球生命科学公司,致力于将创新科学转化为患者的价值。我们在肿瘤、眼科、泌尿、免疫和女性健康等疾病领域提供变革性的治疗方案。通过我们研究与开发项目,我们正在为具有高度未满足医疗需求的疾病开创全新的医疗解决方案。了解更多信息,请访问:www.astellas.com
关于威络益(佐妥昔单抗)
威络益(佐妥昔单抗)是同类首创的单克隆抗体(MAb),专门设计并用于靶向CLDN18.2阳性的肿瘤细胞,CLDN18.2是一种跨膜蛋白。临床前研究表明,通过与CLDN18.2结合,威络益(佐妥昔单抗)可激活两种独特的免疫系统通路——抗体依赖性细的细胞毒性(ADCC)和补体依赖性细胞毒性(CDC),从而诱导癌细胞死亡并抑制肿瘤生长。
威络益(佐妥昔单抗)是全球首个获得监管机构批准的CLDN18.2靶向疗法,也是目前包括中国、欧盟、日本和美国在内的多个国家唯一获批的联合化疗治疗CLDN18.2阳性、HER2阴性胃或胃食管结合部(GEJ)癌的方案。
在评估佐妥昔单抗联合化疗用于HER2阴性、局部晚期不可切除或转移性胃或胃食管结合部腺癌患者的SPOTLIGHT和GLOW这两项3期临床研究中,全部筛选患者中约38%为CLDN18.2阳性(定义为≥75%的肿瘤细胞中显示出中度至强的CLDN18.2膜染色)。这代表了一个规模可观的、可能从靶向一线治疗中获益的患者群体。1,2
安斯泰来与罗氏合作开发了Ventana™ CLDN18 (43-14a) RxDx检测,在获批的地区,病理学家或实验室可使用该检测来识别适合接受威络益(佐妥昔单抗)靶向治疗的患者。
安斯泰来正在3期LUCERNA研究中探索佐妥昔单抗联合帕博利珠单抗和化疗一线治疗CLDN18.2阳性、HER2阴性、PD-L1阳性局部晚期不可切除或转移性胃或胃食管结合部腺癌患者。更多信息请访问clinicaltrials.gov,试验编号为NCT06901531。
关于ASP3082(setidegrasib)
ASP3082是一款安斯泰来自主研发的靶向KRAS G12D突变的选择性蛋白降解剂。该突变存在于约40%的胰腺导管腺癌中。3作为一种潜在的同类首创疗法,ASP3082目前正在针对携带KRAS G12D突变的转移性或局部晚期不可切除实体瘤患者开展1期临床研究。此外,安斯泰来还在推进另一款靶向KRAS G12D突变的ASP4396,该药物正处于1期研究中。更多信息请访问clinicaltrials.gov,试验编号为NCT05382559(ASP3082)或NCT06364696(ASP4396)。
目前这些在研药物用于所研究适应症的安全性和疗效尚未确证,且无法保证其能够获得监管批准并在相关适应症中投入市场。
安斯泰来警戒声明
本新闻稿中,有关当前计划、估计、战略和信念以及其他非历史事实的陈述,均为关于安斯泰来未来表现的前瞻性陈述。这些陈述是根据管理层结合当前可获得的信息而形成的当前假设和信念得出的,并涉及已知和未知的风险与不确定性。许多因素可能导致实际结果与前瞻性陈述中讨论的结果产生重大差异。这些因素包括但不限于:(i)与制药市场有关的一般经济条件和法律法规的变化,(ii)货币汇率波动,(iii)新产品上市的延迟,(iv)安斯泰来无法有效地销售现有产品和新产品,(v)安斯泰来无法继续有效地研究和开发在竞争激烈的市场中被客户接受的产品,以及(vi)第三方侵犯安斯泰来的知识产权。
本新闻稿中包含的有关药品(包括当前正在开发的产品)的信息并不构成广告或医疗建议。
1.本文翻译自安斯泰来全球新闻稿,原文链接为:Astellas to Present New Clinical Data Across Its Gastrointestinal Cancers Portfolio at 2026 ASCO GI Cancers Symposium
2.“本文所涉及的药品为研究中的药品,尚未在中国获批适应症, 安斯泰来中国不推荐任何未获批的药品使用(除中国大陆已获批的特殊地域外)。
3.本文旨在传递医药前沿信息,不构成对任何药物或诊疗方案的推荐或推广。
4.如您想了解更多疾病知识或药品、诊疗相关信息,请咨询医疗卫生专业人士。
References
1 Shitara K, et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. Lancet. 2023;401(10389):1655-1668.2 Shah MA, et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nat Med. 2023;29(8):2133-2141.
3 Lee, JK et al. Comprehensive pan-cancer genomic landscape of KRAS altered cancers and real-world outcomes in solid tumors. NPJ Precis Oncol. 2022;9;6(1):91.