41种创新药里的学问
核心提示:每年,FDA药品评价和研究中心(以下简称“CDER”)都会批准几百个新的药物,其中绝大多数是现有药物的更新如新剂型,或是仿制药。但也有很小一部分是真正的新产品,即创新型新药(以下简称为“新药”),这类新药是真正的革新性产品,将临床治疗推进到一个新高度。
每年,FDA药品评价和研究中心(以下简称“CDER”)都会批准几百个新的药物,其中绝大多数是现有药物的更新如新剂型,或是仿制药。但也有很小一部分是真正的新产品,即创新型新药(以下简称为“新药”),这类新药是真正的革新性产品,将临床治疗推进到一个新高度。
正如CDER主任珍妮特·伍德库克所指出的那样,2014年FDA批准的新药更多地专注于病人迫切需要的药物。比如批准的孤儿药数量是历史上最多的;超过一半的新药通过“优先审评”途径予以批准;获批的“突破性疗法”药物是2013年的3倍多;另外,还有一些新型抗生素获得批准。

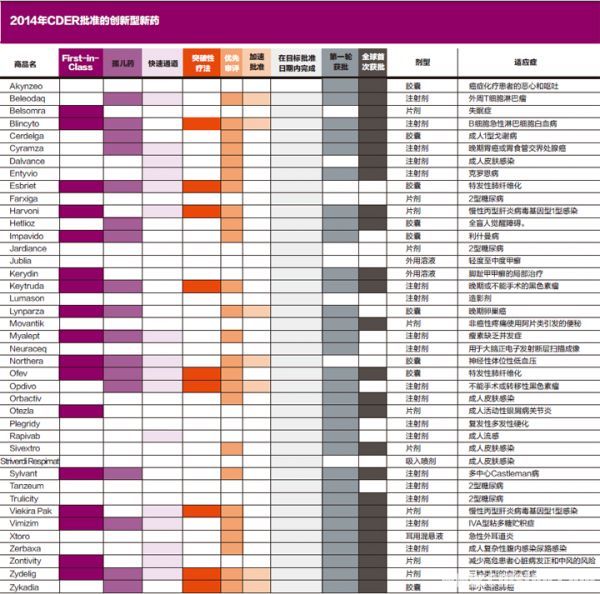
2014年,CDER共批准了41个创新型新药,是过去10年来新药获批数量最多的一年。2005~2013年,CDER平均每年批准大约25个创新型新药。
其中,CDER批准的First-in-Class药物占全部获批新药的41%,一共17种。最值得关注的是3个:吉利德治疗慢性丙型肝炎的药物Harvoni、默沙东用于不能手术或者转移性黑色素瘤的Keytruda和抗血小板药物Zontivity。
另外,2014年CDER审批通过的41个新药里,大约有41%是用于治疗罕见病的孤儿药。美国定义罕见病为在该国患者数等于或少于20万人的疾病。这些药物中值得关注的有6个。
它们分别是治疗IVA型粘多糖病的Vimizim、治疗利什曼病的Impavido、治疗多中心性Castleman病的Sylvant、治疗戈谢病的Cerdelga、治疗特发性肺纤维化的Esbriet和Ofev以及治疗缺乏激素瘦素导致的脂肪代谢障碍的Myalept。
除了前面提到的First-in-Class药物和罕见病药物外,2014年CDER批准的创新型新药中还包括一些其他领域的重要药物。比如,4个II型糖尿病药物:Farxiga、Jardiance、Tanzeum和Trulicity;根据新的激励计划获批的4个抗生素:Dalvance、Sivextro、Orbactiv和Zerbaxa;还有一个是丙型肝炎药物的四联药组合Viekira Pak。
4种加快审批办法
CDER加快创新型新药获批的方法一般包括4个:快速通道、突破性疗法、优先审评和加速批准。2014年总共有27种创新型新药通过以上4种方法中的一种或几种获得批准。这些方法加速了开发过程和审评过程,帮助重要的药物尽快进入市场。
快速通道可以加速新药的开发和审评。比如可以增加FDA与药物开发商的交流时间,还可以在完整的申请提交之前让CDER先审查部分申请内容。2014年批准的创新型新药中有17个被CDER指定为快速通道,这意味着这些药物有潜力解决现在未被满足的医疗需求。
获得突破性疗法认定的药物,意味着初步的临床证据表明,与现有药物相比,这些药物可以显着提升疗效。所以新药被指定为突破性疗法后,不止获得所有快速通道药物的优惠政策,而且FDA还会对于药物有效性研究给予更密集的指导。这一举措旨在缩短有前途新药的开发时间。2014年CDER给予9个获批的创新型新药突破性疗法的指定。
优先审批是给予那些有潜力显著提高疗效的药物,这类药物的审评时间将从标准的10个月缩短至6个月。2014年批准的创新型新药中有25个通过优先审评获得批准。
加速批准是授予用于治疗严重的或者危及生命的疾病的药物,且这些药物的疗效优于现有药物。一旦一个药物被授予加速批准,那么这个药物必须经过进一步地测试来确认其受益性,以使需要该药的患者尽早获得药物。2014年CDER按照加速批准途径批准了8个创新型新药。
这些加快创新药审批办法的使用,再加上FDA的处方药申请付费法案所确保的FDA药物审批资金来源,使得2014年98%的新药审批都能够在既定日期甚至之前完成,且78%创新型新药在第一轮审评中就能够获得批准。
责任编辑:露儿
-
医院新规:查医药代表 挂钩产品
大医院严查医械代表再升级!私下接触医务人员,直接停止采购公司代理产品。...
-
编外人员被收保证金?医院取消编制大势所趋
看到一家县级医院向编外人员收取5000元工作保证金,限时不交清者,医院不再使用,老徐认为:编制制度或早已不适应医院发展需要了。...
-
三甲医院:8个药询价 要求至少稳定供货半年
三甲医院:供货不稳定,踢出一年。...
-
5省497名执业药师挂证被查实
今年“3•15”后,执业药师“挂证”问题引起全社会关注,按照国家药监局要求,自2019年5月1日起,各省级局组织对行政区域内的药品零售企业开展监督检查。...
-
又一大药陷入致癌风波 多家外企全球召回产品!
一些雷尼替丁药物又被查实含有NDMA杂质,目前山德士、葛兰素史克、印度瑞迪博士药厂均已停止雷尼替丁的供应并召回!...
-
大洗牌!国务院检查组,进入医疗器械企业了
国家严惩在医疗器械购买、销售、纳税...等多个环节的违规情况。...
-
4+7全国扩围,中标结果流出
大跌眼镜!4+7全国扩围结果出炉,有外企低价入围,部分原中选药企落标,多个品种再次刷新底价!...
-
国务院发文:医械行业,筛选重点企业监管
当监管方式越来越科学,不合规或打擦边球的械企面临的压力就越来越大。...
-
报告显示:多数医生不再愿意接待医药代表
报告显示,医生不再愿意接待医药代表,医药代表的必要性在降低。...
-
750家医药企业,最新离职率公布
2019年1月到6月的市场薪酬数据白名单公布,其中医药行业的行业增长和薪酬增长都维持稳定的高位;此外,报告采集了750家医药公司的数据,医药人的平均离职率仅为5.91%,为所有行业中最低的。...
-
63个药,底价曝光(附名单)
(9月6日),山东省药品集中采购网发布《关于山东省药品集中采购拟备案采购产品最低外省及拟挂网价格公示的通知》(以下简称《通知》)。...
-
医药业平均月薪公布 仍是最好的就业去向之一
据东方财富Choice数据,医药行业平均月薪为1.03万,同比涨幅较大,为11.75%,仅次于公用事业等行业,排名第六名。...





















