新药准入面临障碍 中国患者用药晚8年
核心提示:创新药物可以提高社会的人均寿命,并从整体上降低患者的医疗成本。但由于中国的新药准入方面还存在较多障碍,导致新药上市时间较晚。
新药可降低整体医疗成本延长病人生命
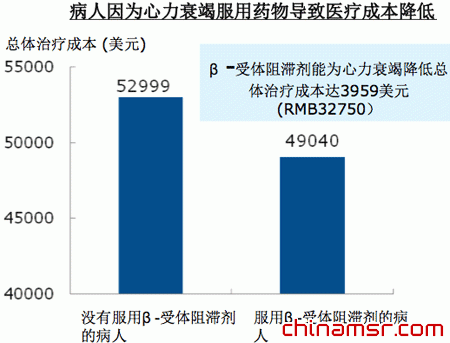
新药对整个社会到底有什么样的意义?首先,对个人来说使用新药会降低治疗成本。以心力衰竭为例,没有服用新药β受体阻滞剂的病人总体治疗成本是52999美元,服用β受体阻滞剂的病人总体治疗成本是49040美元,新药使治疗成本降低了接近4千美元。
|
| 病人因为心力衰竭服用药物导致医疗成本降低 |
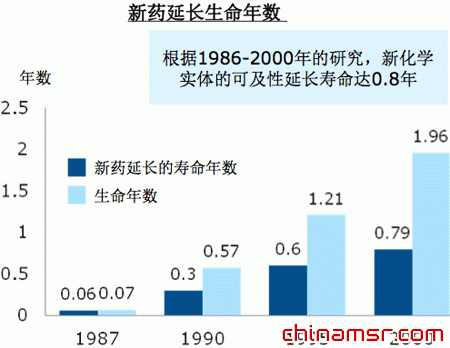
新药对整个社会的贡献,除了提供更为有效的治疗手段、帮助优化医疗资源外,还会延平均长寿命。从1987年到2000年这十多年中,人均寿命延长了接近两年,其中新药贡献了0.8年,接近40%。
|
| 新药延长生命年数 |
该研究采纳了美国联邦调查机构的数据,对大量、有代表性的医疗服务提供者和家庭进行了调查,数据涵盖了不同的医疗情形和药物。美国的Lichtenberg教授说:可供治疗的药物越多,老百姓的人均寿命会越长。比如很多肿瘤、糖尿病以及感染性疾病的患者,由于大量使用了新药,寿命得以延长。同时,新药能够使人们在晚年生活得更健康。
中国的新药准入面临诸多障碍 患者用药晚8年
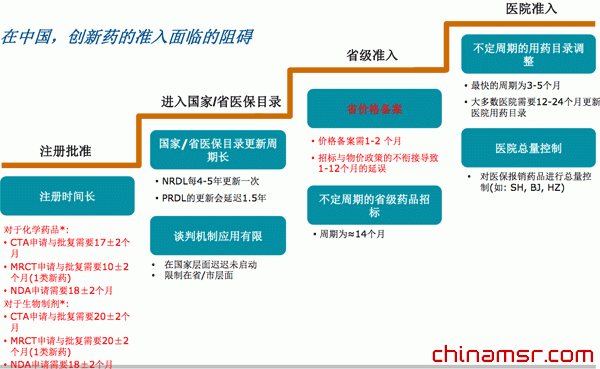
我们在中国也做了大量的调查,访问了不下50家医药企业,以及230家三级和二级医院。在中国,新药的准入面临非常多的障碍,这导致了创新药生产企业无法及时补偿研发投资,并且限制了对未来更多治疗领域的开发投入。如果这种恶性循环一直持续下去,会导致越来越少的企业继续新药研发。
|
| 在中国创新药的准入面临的阻碍 |
在中国,创新药准入面临的阻碍,第一个是注册批准。新药为两类,一类化学药,一类是生物制品,如抗体药、免疫球蛋白等。分开来看,化学类药品的新药,拿到临床准入证(CTA)大概需要17、18个月,也就是一年半的时间。一个新药从实验室研发出来,到社会上进行临床实验,光等待准入证就需要花1年半的时间。
MRCT的申请是一个国际临床多中心实验的申请,就是说在国际上如果已经通过了这个药品的注册,在中国还要等待12个月,一年左右的时间,然后才能在中国进行临床实验。
因为药品注册是一个非常烦琐的过程,在我国还面临着额外等待的时间,这个时间从一年到两年不等。
如果千辛万苦,通过药监局拿到临床准入,拿到市场生产许可证,上市之后新药还会面临着什么样的问题?如何进入国家和省级医保目录。
世界上各个国家,医疗保险计划都对新药的普及有非常关键的作用。我国的医保目录04年有一版,09年有一版,基本上每五年更新一次,也就是说如果错过了5年一次的窗口,就需要再等下一个五年,才能够被国家批准到考虑范围之内。
新医保目录到省里的执行还会再延长一到两年的时间,所以新药在六到七年的时间里无法获得国家医保的支持。
虽然国家也意识到很多新药如癌症用药、抗体药很多都是救命药,但是由于研发费用昂贵,上市之后药品价格也比较高,所以医保很难负担。为此我国单独设立了一个谈判机制,跟厂商建立合作,共同解决新药支付能力问题。不过,虽然国家在09年就提出了谈判机制,但直到2012年国家层面仍没有启动正式的谈判规划,所以对新药来说,特别是生物药面临着非常大的挑战。
再看省级这一部分,新药上市之后,第一个要面临的问题就是如何拿到省里的价格备案,在省物价局和发改委确定药品的价格,这个价格备案需要四五个月的时间。
拿到药品定价之后,还要去省里进行招标,由于招标和物价政策不衔接,经常导致药品在上市后还有不到一年的等待时间。
虽然国家希望有一个统一的招标政策,但目前各个省还是千差万别,不同的省份有不同的政策。总体来说,如果招标周期是14个月,一个新药上市后如果没赶上这14个月,就只能等到下一个周期,没有招标在医院就不能进医院销售,所以只能等。
既使过了招标周期,还要面临着医院和药店准入。每个医院都设有药事委员会,药品进入医院必须经过药事委员会审批。所以药事委员会多久召开一次也决定了新药进入医院药房的快慢程度。我们在全国调研了200多家三甲医院,其中北京协和医院是每3个月召开一次药事委员会,这是全国所有医院中时间最短的,也是全国唯一的一家,做得最好的一家。但大部分医院需要等待一到两年才召开一次,阻碍了新药进入医院。
进入医院后,现在还面临着对医保报销药品的政策调控,如上海的总量控制,北京的按病种的付费。中国确实还是个发展中国家,政府资源有限,但是因为药品控费机制的问题,也确实导致了患者很多药用不上。
|
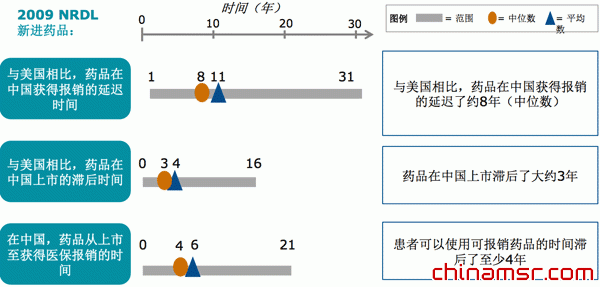
| 在中国,药品注册滞后2年左右,因此新药从注册至获得医保,平均滞后时间为6-8年 |
综合所述,新药在中国面临的挑战非常多,跟国际上的发达国家相比我们到底有多滞后?结论显示由于药品在中国上市和获得报销的滞后,患者用药慢了大约8年。
专利药品在中国实际获益时间短
美国是创新药物比较领先的国家,我们对比了几百个药品获得医保报销的时间,发现中国比美国平均晚11年,按中位数来说也会晚8年。也就是说,中国一个药品从上市之后到获得国家医保,跟美国药品上市到获得相对应的医保覆盖,相差8-11年左右的时间。

|
| 病人因为心力衰竭服用药物导致医疗成本降低 |
第二,由于政府的各种政策管控,导致新药在中国上市会滞后3-4年左右的时间。就是说中国的药品从实验室开发出来,一直到上市之前所经历的实验室实验和临床实验等,再到药品被批准,准备上市,这个过程中国跟美国企业相比会晚3-4年。
总体来说,在中国药品上市获得医保的时间,再加上药品注册的时间,平均会比发达国家晚6-8年。新药虽然在很多发达国家乃至发展中国家都已经上市,获得了医保支持,老百姓可以触摸到的情况下,在中国还要滞后6-8年。
一个药品的专利有20年的时间,这20年决定了这个药品的成功与否。国家创新一类新药从新药申请,到临床,到NDA的申请,到进入国家医保目录,到最后进入医院,中国平均花费要16年的时间,药品专利只有20年的时间,前16年都花在了各种准备上。真正有医保覆盖、老百姓能拿到药品的时间,只有四年多一点。
跨国公司在中国有两种情况,一种是这个药在国外已经上市了,引入中国后要从头做相应的药品实验,所以到这个药品在中国上市时,已经过了专利期大概一年多。因此很多跨国公司虽然想把更多的新药引入中国,但是中国的环境条件让很多企业望而却步。
很多跨国公司解决问题的办法是同时在中国做多中心临床实验,希望加速新药在中国上市的时间。中国跟国外同时开始新药的申请,同时做国际多中心临床实验,到拿到国家医保,到上市之后,大概留给他的时间是5.2年。这个情况稍微乐观一点,比纯粹国内研发的产品还能保持一年多的专利保护期。
但是跟其他国家比,从研发到上市,到获得医保投入,在德国药品还有12年左右的时间;美国、法国、日本,大多都是超过十年左右的回报时间。
|
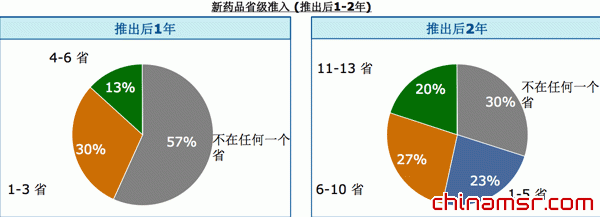
| 在过去的5年中推出的新药物,只有20%在第二年取得了在11-13省的准入 |
我们把中国在过去五年上市的200多个新药进行数据对比,在获得药品审批之后,拿到药监局准入证,进入到省级招标,以上市之后第二年为时间点来看,其实形势也不是很乐观,三分之一的药在上市两年之后还不能进入到任何一个省进行销售;能进入1到5个省销售的药品占23%;能进入一半以上的省销售的药品,比例不到20%,这个速度非常缓慢。
|
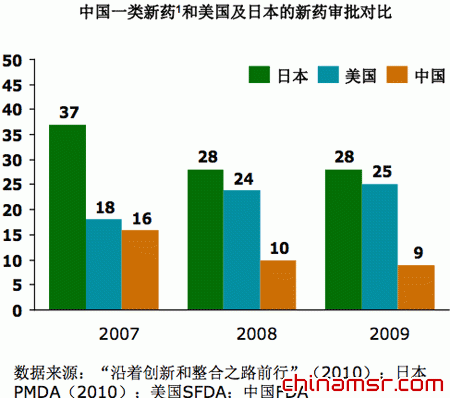
| 与美国和日本相比,在中国上市的创新药数量较少 |
从另外一个角度来看,虽然我国一直在鼓励创新,但跟日本和美国相比,中国上市的创新一类新药数量是非常可怜的。07-09年日本一类新药每年上市30个左右,美国是25个左右,中国不到10个,而且还在呈下降趋势。从新药研发来说,每一个新分子需要13亿美元的投入,而中国每年能够上市的还不到10个创新药,我国医药创新的路任重道远。
[作者简介]张猛,艾美仕市场研究公司(IMS)中国区咨询业务负责人,IMS是一家专注于为医药健康产业提供专业信息和战略咨询服务的公司。
责任编辑:中国医药联盟
-
医院新规:查医药代表 挂钩产品
大医院严查医械代表再升级!私下接触医务人员,直接停止采购公司代理产品。...
-
编外人员被收保证金?医院取消编制大势所趋
看到一家县级医院向编外人员收取5000元工作保证金,限时不交清者,医院不再使用,老徐认为:编制制度或早已不适应医院发展需要了。...
-
三甲医院:8个药询价 要求至少稳定供货半年
三甲医院:供货不稳定,踢出一年。...
-
5省497名执业药师挂证被查实
今年“3•15”后,执业药师“挂证”问题引起全社会关注,按照国家药监局要求,自2019年5月1日起,各省级局组织对行政区域内的药品零售企业开展监督检查。...
-
又一大药陷入致癌风波 多家外企全球召回产品!
一些雷尼替丁药物又被查实含有NDMA杂质,目前山德士、葛兰素史克、印度瑞迪博士药厂均已停止雷尼替丁的供应并召回!...
-
大洗牌!国务院检查组,进入医疗器械企业了
国家严惩在医疗器械购买、销售、纳税...等多个环节的违规情况。...
-
4+7全国扩围,中标结果流出
大跌眼镜!4+7全国扩围结果出炉,有外企低价入围,部分原中选药企落标,多个品种再次刷新底价!...
-
国务院发文:医械行业,筛选重点企业监管
当监管方式越来越科学,不合规或打擦边球的械企面临的压力就越来越大。...
-
报告显示:多数医生不再愿意接待医药代表
报告显示,医生不再愿意接待医药代表,医药代表的必要性在降低。...
-
750家医药企业,最新离职率公布
2019年1月到6月的市场薪酬数据白名单公布,其中医药行业的行业增长和薪酬增长都维持稳定的高位;此外,报告采集了750家医药公司的数据,医药人的平均离职率仅为5.91%,为所有行业中最低的。...
-
63个药,底价曝光(附名单)
(9月6日),山东省药品集中采购网发布《关于山东省药品集中采购拟备案采购产品最低外省及拟挂网价格公示的通知》(以下简称《通知》)。...
-
医药业平均月薪公布 仍是最好的就业去向之一
据东方财富Choice数据,医药行业平均月薪为1.03万,同比涨幅较大,为11.75%,仅次于公用事业等行业,排名第六名。...










 (0)
(0)










