CFDA通告,3药企5品种被停产!
核心提示:昨天(11月3日),国家食药总局发布通告,公布了对3家企业5批次药品跟踪抽验不合格的信息。
昨天(11月3日),国家食药总局发布通告,公布了对3家企业5批次药品跟踪抽验不合格的信息。
通告显示,近期,国家食品药品监督管理总局在组织开展的跟踪抽验中发现,标示为贵州天地药业有限责任公司生产的地塞米松磷酸钠注射液、广西迪泰制药有限公司生产的康尔心胶囊和湖南一格制药有限公司生产的转移因子经检验不合格。相关情况如下:
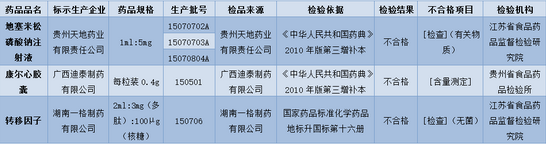
经江苏省食品药品监督检验研究院检验,发现标示为贵州天地药业有限责任公司生产的3批次地塞米松磷酸钠注射液不合格,批号分别为15070702A、15070703A和15070804A,不合格项目为有关物质。
经贵州省食品药品检验所检验,发现标示为广西迪泰制药有限公司生产的批号为150501的康尔心胶囊不合格,不合格项目为含量测定。
经江苏省食品药品监督检验研究院检验,发现标示为湖南一格制药有限公司生产的批号为150706的转移因子不合格,不合格项目为无菌。
总局表示,对上述不合格药品,贵州、广西、湖南省(区)食品药品监督管理局已采取了查封扣押、责令召回、暂停销售使用等产品控制措施。
另外,从通告中得知,贵州天地药业有限责任公司、广西迪泰制药有限公司和湖南一格制药有限公司3家企业生产的上述药品在既往国家药品抽验中曾被检出不合格产品,此次经跟踪抽验再次检出不合格产品,反映该3家企业在生产质量管理方面存在突出问题。
由此,国家食品药品监督管理总局要求湖南、广西、贵州省(区)食品药品监督管理局立即责令上述企业暂停相关产品生产,彻查药品质量问题原因,查清原因并整改到位前不得恢复生产;依据《中华人民共和国药品管理法》等规定对上述企业立案调查,依法严肃处理,相关情况及时向社会公开;
同时,将上述企业列为重点监管对象。
附件:5批次不合格药品名单
责任编辑:露儿
-
医院新规:查医药代表 挂钩产品
大医院严查医械代表再升级!私下接触医务人员,直接停止采购公司代理产品。...
-
编外人员被收保证金?医院取消编制大势所趋
看到一家县级医院向编外人员收取5000元工作保证金,限时不交清者,医院不再使用,老徐认为:编制制度或早已不适应医院发展需要了。...
-
三甲医院:8个药询价 要求至少稳定供货半年
三甲医院:供货不稳定,踢出一年。...
-
5省497名执业药师挂证被查实
今年“3•15”后,执业药师“挂证”问题引起全社会关注,按照国家药监局要求,自2019年5月1日起,各省级局组织对行政区域内的药品零售企业开展监督检查。...
-
又一大药陷入致癌风波 多家外企全球召回产品!
一些雷尼替丁药物又被查实含有NDMA杂质,目前山德士、葛兰素史克、印度瑞迪博士药厂均已停止雷尼替丁的供应并召回!...
-
大洗牌!国务院检查组,进入医疗器械企业了
国家严惩在医疗器械购买、销售、纳税...等多个环节的违规情况。...
-
4+7全国扩围,中标结果流出
大跌眼镜!4+7全国扩围结果出炉,有外企低价入围,部分原中选药企落标,多个品种再次刷新底价!...
-
国务院发文:医械行业,筛选重点企业监管
当监管方式越来越科学,不合规或打擦边球的械企面临的压力就越来越大。...
-
报告显示:多数医生不再愿意接待医药代表
报告显示,医生不再愿意接待医药代表,医药代表的必要性在降低。...
-
750家医药企业,最新离职率公布
2019年1月到6月的市场薪酬数据白名单公布,其中医药行业的行业增长和薪酬增长都维持稳定的高位;此外,报告采集了750家医药公司的数据,医药人的平均离职率仅为5.91%,为所有行业中最低的。...
-
63个药,底价曝光(附名单)
(9月6日),山东省药品集中采购网发布《关于山东省药品集中采购拟备案采购产品最低外省及拟挂网价格公示的通知》(以下简称《通知》)。...
-
医药业平均月薪公布 仍是最好的就业去向之一
据东方财富Choice数据,医药行业平均月薪为1.03万,同比涨幅较大,为11.75%,仅次于公用事业等行业,排名第六名。...






















