一批新药将上市:恒瑞、东阳光、正大天晴...
多款新药上市有新进展,国内外头部药企均有斩获
23款新药上市有进展!2款国产1类新药首次获批
6月26日-7月16日期间,23个新药(33个受理号)的上市申请有审评审批状态更新。9款国产新药获批上市,其中2款1类新药首次获批,包括艾迪药业的艾诺韦林片(曾用名ACC007片)、海正药业的海泽麦布片;3个新药获批进口,安进的注射用卡非佐米、萌蒂的盐酸羟考酮缓释片首次获批。
此外,神州细胞的注射用重组人凝血因子(Ⅷ)、北京博康健的注射用重组人特立帕肽、礼来的注射用盐酸吉西他滨、赛诺菲的碳酸司维拉姆片、阿斯利康的奥拉帕利片等7个药品的注册办理状态变更为“在审批”。
(6.26-7.16)新药上市申请审评审批状态更新
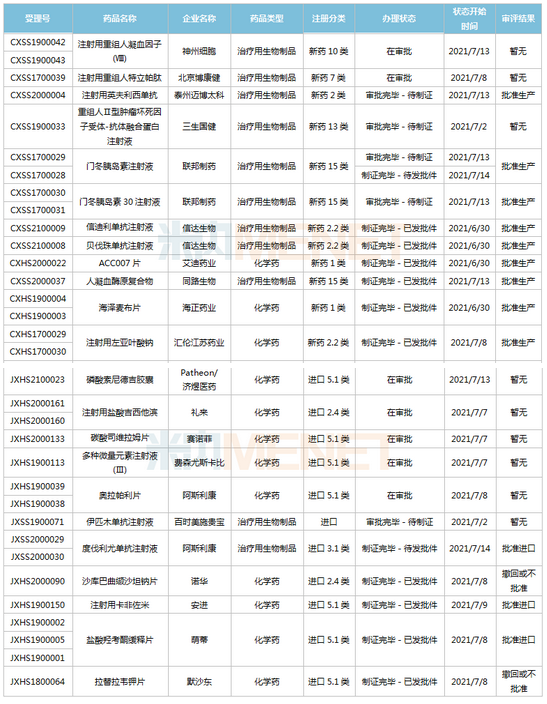
2款国产1类新药首次获批上市。海博麦布片是海正药业首个获批上市的1类新药,这是一款胆固醇吸收抑制剂,用于治疗原发性高胆固醇血症。同靶点上市药物为默沙东的依折麦布,全球销售峰值达26.6亿美元,2020年在中国城市公立医院、县级公立医院、城市社区中心以及乡镇卫生院(简称中国公立医疗机构)及中国城市实体药店终端合计销售额接近10亿元;艾诺韦林片(曾用名ACC007片)是全新结构的非核苷类逆转录酶抑制剂,是艾迪药业首个获批的抗艾滋病1类新药。
联邦制药2款胰岛素获批上市,均为国产第2家。门冬胰岛素注射液是一种速效的人胰岛素类似物,门冬胰岛素30注射液是由可溶性门冬胰岛素和精蛋白门冬胰岛素按30:70的比例组成的预混胰岛素。米内网数据显示,2020年中国公立医疗机构及中国城市实体药店终端胰岛素及其类似药销售规模超过300亿元。
首次在国内获批的注射用卡非佐米是百济神州/安进联合开发的一款蛋白酶体抑制剂,联合地塞米松治疗复发或难治性多发性骨髓瘤。该产品于2012年在全球首次获批,2020年全球销售额超过10亿美元。
英夫利西单抗是强生/默沙东研发的一款特异性阻断肿瘤坏死因子(TNF-α)的人鼠嵌合型单克隆抗体,全球销售峰值达92.4亿美元,虽然受到生物类似药冲击,但2020年仍实现40.77亿美元的销售额。泰州迈博太科药业的注射用英夫利西单抗是国内首款获批上市的英夫利西单抗生物类似药,使用CHO表达系统,比原研产品更安全且免疫原性更低。
21款新药申请上市!正大天晴、人福......4款1类新药来袭
6月26日-7月16日期间,21个新药(28个受理号)上市申请获得CDE承办。12款为国产新药,其中4款为1类新药,包括正大天晴康方的派安普利单抗注射液、银珠医药/长城制药的羧胺三唑软胶囊、光谷人福的广金钱草总黄酮胶囊及乐普生物/鼎康生物的普特利单抗注射液;10款为进口新药,赛生医药的那昔妥单抗注射液、梯瓦医药的醋酸格拉替雷注射液、信达的Pemigatinib片、武田的Mobocertinib胶囊、康哲药业的地西泮鼻喷雾剂、协和麒麟的莫格利珠单抗注射液为首次报产。
(6.26-7.16)获承办的国产/进口新药上市申请
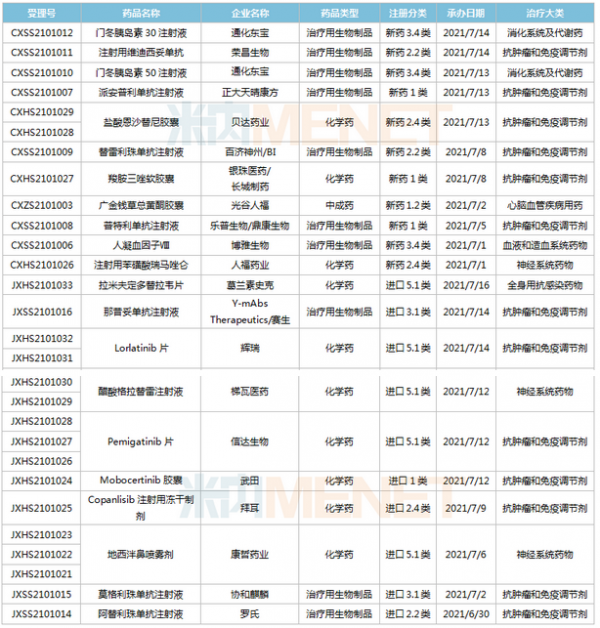
2款PD-1单抗申报上市。乐普生物的普特利单抗注射液属于差异化设计的PD-1抗体,在IgG4的Fc引入S254T/V308P/N434A突变延长半衰期;正大天晴康方的派安普利单抗注射液具有同类最佳的潜力,与国外已上市PD-1相比抗原结合解离速率较慢。目前国内已有6款PD-1单抗获批上市,分别为帕博利珠单抗、纳武利尤单抗、信迪利单抗、特瑞普利单抗、卡瑞利珠单抗及替雷利珠单抗。此外,还有5款PD-1的上市申请还在审,包括普特利单抗、派安普利单抗、杰洛利单抗、赛帕利单抗以及斯鲁利单抗。
通化东宝2款预混型门冬胰岛素申报上市。门冬胰岛素50注射液仅原研厂家诺和诺德的产品在售,通化东宝首家报产;甘李药业、联邦制药的门冬胰岛素30注射液已获批,东阳光药、通化东宝的产品已报产。米内网数据显示,2020年中国公立医疗机构及中国城市实体药店终端门冬胰岛素销售规模超过80亿元。
pemigatinib片是信达生物引进的一款成纤维细胞生长因子受体(FGFR)1/2/3抑制剂,用于有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌。该产品已于2021年6月21日在台湾获批上市,是信达生物获批的首款小分子新药,也是公司第五款获批上市的创新药。
Mobocertinib(TAK-788)是武田研发的一种新型、高选择性的“first-in-class”口服酪氨酸激酶抑制剂(TKI),拟用于治疗携带表皮生长因子受体(EGFR)20号外显子插入突变的非小细胞肺癌,目前全球范围内暂未获批,此次在中国申请上市首次实现了中国与全球的同步递交。
协和麒麟的莫格利珠单抗注射液(Mogamulizumab)属于抗CC趋化因子受体4(CCR4)单克隆抗体,2012年首次在日本获批,2018年获得FDA批准上市。Mogamulizumab有望成为国内首款“first-in-class”的CCR4抑制剂,为复发性或难治性皮肤T细胞淋巴瘤患者提供新的治疗选择。
康哲药业引进的地西泮鼻喷雾剂结合了基于维生素E的溶剂和Intravail吸收增强剂的独特组合,以期在鼻腔配方中获得突出的吸收性、耐受性和可靠性。这是国内首款报产的地西泮鼻喷雾剂,用于治疗六岁及以上癫痫患者的间歇性、刻板性癫痫频繁发作活动。米内网数据显示,2020年中国公立医疗机构终端地西泮销售规模超过7000万元。
那昔妥单抗注射液是赛生医药引进的一款神经节苷脂GD2人源化单克隆抗体,通过靶向高表达于神经母细胞瘤的GD2起效。该产品于2020年11月25日首次获得FDA加速批准上市,用于治疗复发/难治性高危神经母细胞瘤。目前全球有3款靶向GD2治疗神经母细胞瘤的单抗产品获批,国内市场暂时空白。
梯瓦的醋酸格拉替雷注射液是由谷氨酸、丙氨酸、酪氨酸和赖氨酸四种氨基酸组成一种合成肽类化合物,被认为是通过改变造成多发性硬化(MS)发病机制的免疫过程而起作用的,可降低复发性MS患者的复发频率。该产品2020年全球销售额为13.37亿美元,可见临床需求之大。
多款新药新适应症报产,包括百济神州的PD-1替雷利珠单抗(局部晚期或转移性食管鳞状细胞癌)、荣昌生物的ADC药物维迪西妥单抗(局部晚期或转移性尿路上皮癌)、贝达的恩沙替尼(ALK阳性非小细胞肺癌)等。
科伦、东阳光药、恒瑞......69个新药获批临床,国产新药高歌猛进
6月26日-7月16日期间,69个新药(涉及96个受理号)获得临床试验默示许可。其中,51个品种(70个受理号)为国产新药(42个1类新药),18个品种(26个受理号)为进口新药。从药品类型看,化学药有37个、治疗用生物制品有32个。
(6.26-7.16)获批临床的国产/进口新药
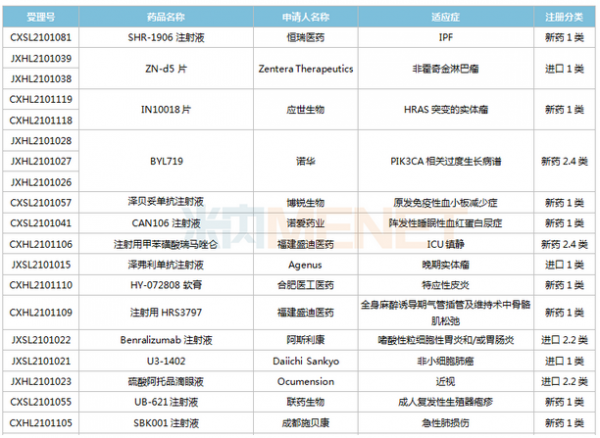





恒瑞医药有6款新药获批临床,包括SHR-1906注射液、注射用甲苯磺酸瑞马唑仑、注射用HRS3797、SHR6508注射液、甲磺酸阿帕替尼片、注射用HR20013。除了甲磺酸阿帕替尼片、注射用甲苯磺酸瑞马唑仑,其余4款1类新药均为首次获批临床。SHR6508注射液拟用于治疗慢性肾脏病维持性血液透析患者的继发性甲状旁腺功能亢进,目前国内尚无同类静脉给药产品上市;注射用HR20013用于预防化疗后恶心呕吐,目前国内外尚未有同类产品获批上市。
中国生物制药2款1类新药获批临床。南京正大天晴NTQ1062片、正大天晴的TQB3811片为首次获批临床,均拟用于治疗实体瘤,作用靶点暂无详细信息。
科伦药业子公司博泰生物开发的1类新药SKB336注射液是一款全新的具有自主知识产权的靶向FXIa/FXI因子的人源化单抗,目前全球尚无同靶点药物获批上市,在研药物包括拜耳的BAY-1213790、诺华的abelacimab(阿贝西单抗),两个产品均处于II期临床。米内网数据显示,2021年至今,科伦药业已有7款新药获批临床(不含补充申请),其中5款为1类新药。
百奥泰的1类新药BAT6021注射液首次获批临床,这是一款经无岩藻糖基化修饰的mAb候选药物,作用靶点为TIGIT,拟用于治疗晚期恶性实体瘤。目前国内暂无同靶点药物获批,在研药物包括百济神州的Ociperlimab(III期临床)、信达的IBI939(I期临床)、君实的JS006(I期临床)等。
豪森、石药、齐鲁……114个新药临床申请获承办
6月26日-7月16日期间,114个新药(涉及164个受理号)的临床申请获CDE承办受理。其中,86个品种(113个受理号)为国产新药,28个品种(51个受理号)为进口新药。从药物类型看,化学药有56个、治疗用生物制品有52个、中成药有6个。86个国产新药中,1类新药有63个。
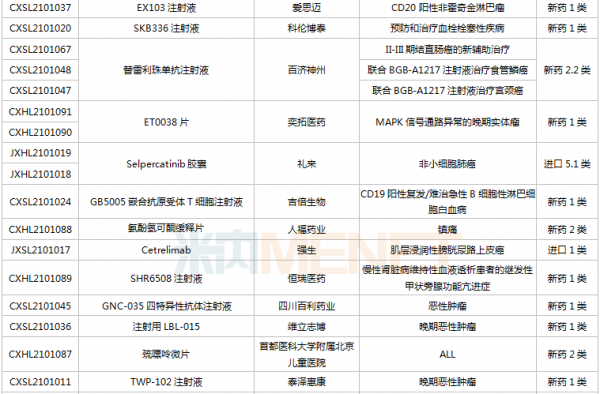
(6.26-7.16)获承办的国产/进口新药临床申请


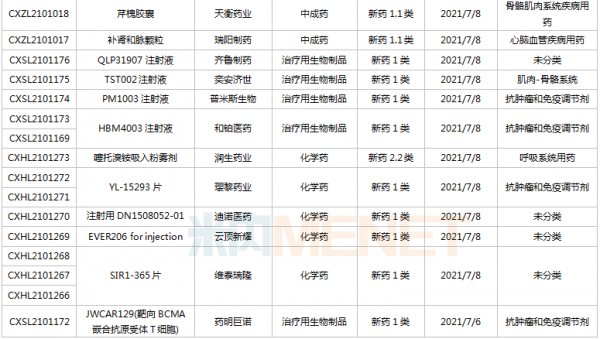

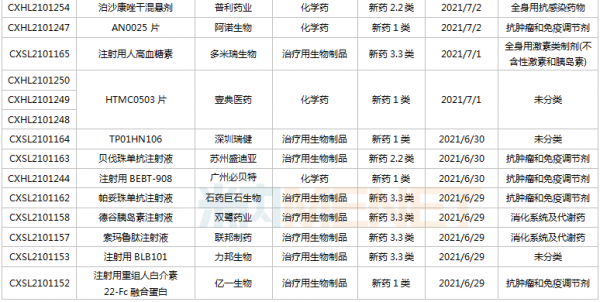
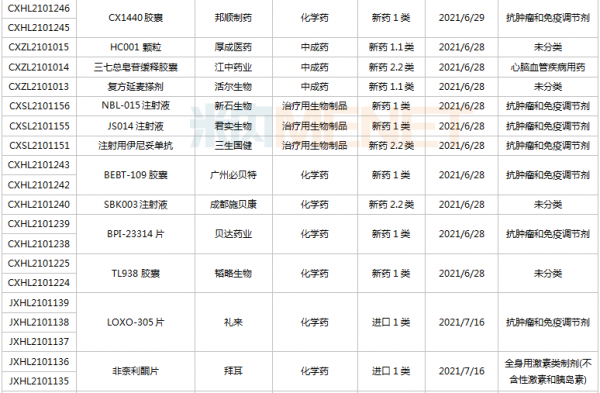
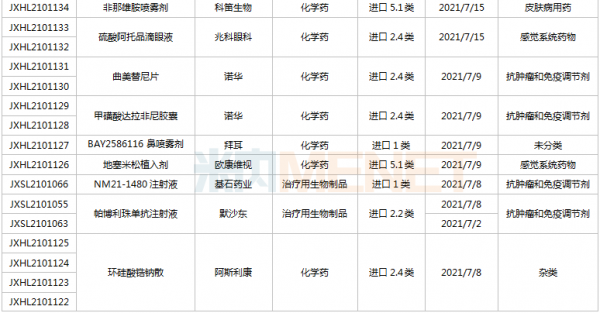
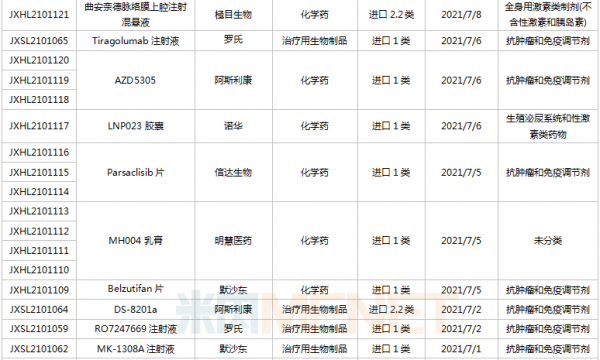
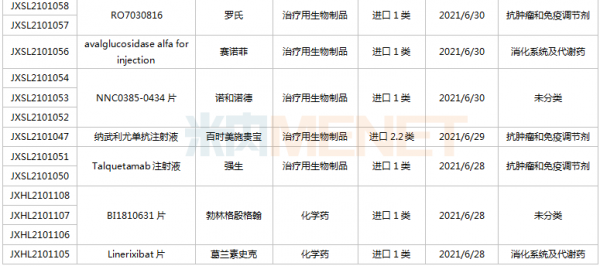
豪森药业有4款新药申请临床,包括HS-10241片、甲磺酸阿美替尼片、注射用HS-20089及注射用HS-20093,其中注射用HS-20089、注射用HS-20093为首次申报,两款新药均为治疗用生物制品。
基石药业首次申报临床的NM21-1480注射液(原代号ND021)是一款针对三个靶点的多特异性抗体,可以同时结合PD-L1与4-1BB,并且还可以结合人血清白蛋白(HSA),ND021独特的单价结构使其在安全窗和抗癌谱方面具备很大的优势。
君实的JS014注射液属于重组白介素21-抗人血清白蛋白(HSA)单域抗体融合蛋白,通过融合抗HSA的单域抗体使IL-21的半衰期得到显著延长,是国内首款申报临床的IL-21融合蛋白。
阿斯利康首次申报临床的AZD5305属于第二代PARP抑制剂,对PARP1具有高度选择性,同时还是高效的PARP1-DNA捕获器,解决了第一代PARP抑制剂与化疗药物联合使用时的毒副作用。
诺和诺德的NNC0385-0434片是国内第3款申报临床的口服PCSK9抑制剂,另外2款为西威埃医药的CVI-LM001和中科院上海药物研究所的DC371739。目前国内2款PCSK9抑制剂获批上市,均为注射剂,分别是赛诺菲的阿利西尤单抗和安进的伊洛尤单抗,暂无口服PCSK9抑制剂获批。
数据来源:米内网数据库、CDE、公司公告。数据统计时间段为6月26日-7月16日,按药品名称统计(不含预防用生物制品、体外诊断试剂等,不含补充申请),如有疏漏,欢迎指正!
注:米内网中国城市实体药店终端竞争格局数据库是覆盖全国293个地市及以上城市实体药店(不含县乡村实体药店),对全品类进行连续监测的放大版城市实体药店数据库。上述销售额以产品在终端的平均零售价计算。
责任编辑:露儿
-
一批药被查 涉维C银翘片、阿胶…
一批药被查 涉维C银翘片、阿胶…...
-
高值耗材最高降价80% 涉雅培、波科、贝朗…
8月1日,云南省曲靖市举行高值医用耗材联盟带量集中采购第一批次中选产品企业签约仪式。...
-
国家指令 整治所有医院回扣 暗访组出发
日前,国家卫健委发布了《2020年医疗行业作风建设工作专项行动方案》,这次方案的重点就是规范医疗机构及其从业人员行为,印发给各省、自治区、直辖市及新疆生产建设兵团卫生健康委,开始组织实施。...
-
医药代表系统学习产品知识的十个步骤
每个刚入行的医药代表初期都会接受公司大量培训,产品知识培训更是重中之重,不仅培训而且还要考试。...
-
“3+6”医用耗材带量采购,价格信息公布
吉林省政府采购中心消息发布《京津冀及黑吉辽蒙晋鲁医用耗材(人工晶体类)联合带量采购文件(LH-HD2020-1)》(下称《采购文件》),公布人工晶体类耗材的具体采购品种、申报价格等信息。 ...
-
首轮价格降幅低于42% 医疗器械企业直接淘汰
首轮价格降幅低于42% 医疗器械企业直接淘汰...
-
Q1最惨淡的两大药品领域,代表都离职了!
中国虽然是世界上最先控制住疫情的国家,但随着全球疫情的爆发,输入病例不断上升,加上中国本土还有不少无症状感染患者,这使得中国经济无法完全恢复正常。...
-
某些药企又要开启新一轮裁员了
做代表难,今年更加难。除了国家级的带量采购,省级也有带量采购,感觉就像是夹缝中求生存。...
-
两家外企大裁员,患教专员全部解散!
两家外企大裁员,患教专员全部解散!...
-
执业药师挂证,面临终生逐出行业的巨大风险
执业药师挂证,面临终生逐出行业的巨大风险...
-
虚开发票2.5亿,涉多家药械企业(附目录)
近日,国家税务总局马鞍山市税务局发布的《重大税收违法案件信息公告2020年3月》显示,51家企业涉嫌虚开发票,其中24家是药械企业或相关资讯、服务企业。...
-
91家药企收入公开:以岭、科伦、康恩贝…
突如其来的新冠肺炎疫情,对中国的冲击力和冲击面都超过了2003年的非典,对中国经济乃至世界经济也产生了不可避免的影响,也严重扰乱了正常的经济运行节奏。...





















